
Ethylacetatstruktur, egenskaber, syntese, anvendelser
Det ethylacetat eller ethylethanoat (IUPAC-navn) er en organisk forbindelse, hvis kemiske formel er CH3COOCtoH5. Den består af en ester, hvor den alkoholiske komponent stammer fra ethanol, mens dens carboxylsyrekomponent kommer fra eddikesyre..
Det er en væske under normale temperatur- og trykforhold, der giver en behagelig frugtagtig aroma. Denne egenskab er perfekt i harmoni med det, der forventes af en ester; hvilket faktisk er den kemiske natur af ethylacetat. Af denne grund finder den anvendelse i fødevarer og alkoholholdige drikkevarer..

Det øverste billede viser skeletstrukturen af ethylacetat. Bemærk til venstre sin carboxylsyrekomponent og til højre den alkoholiske komponent. Fra et strukturelt synspunkt kunne denne forbindelse forventes at opføre sig som en hybrid mellem eddike og alkohol; det udviser dog sine egne egenskaber.
Det er her sådanne hybrider kaldet estere skiller sig ud for at være forskellige. Ethylacetat kan ikke reagere som en syre, og det kan heller ikke være dehydreret på grund af fraværet af en OH-gruppe. I stedet gennemgår den basisk hydrolyse i nærvær af en stærk base, såsom natriumhydroxid, NaOH.
Denne hydrolysereaktion anvendes i undervisningslaboratorier til kemiske kinetiske eksperimenter; hvor reaktionen også er anden orden. Når der forekommer hydrolyse, vender ethylethanoat praktisk talt tilbage til sine oprindelige komponenter: syre (deprotoneret af NaOH) og alkohol.
I dets strukturelle skelet observeres det, at brintatomer dominerer over iltatomer. Dette påvirker deres evne til at interagere med arter, der ikke er så polære som fedtstoffer. Ligeledes anvendes det til at opløse forbindelser såsom harpikser, farvestoffer og generelt organiske faste stoffer..
Trods en behagelig aroma har langvarig eksponering for denne væske en negativ indvirkning (som næsten alle kemiske forbindelser) på kroppen..
Artikelindeks
- 1 Struktur af ethylacetat
- 1.1 Fravær af hydrogenbindingsdonatomer
- 2 Fysiske og kemiske egenskaber
- 2.1 Navne
- 2.2 Molekylær formel
- 2.3 Molekylvægt
- 2.4 Fysisk beskrivelse
- 2.5 Farve
- 2.6 Lugt
- 2.7 Smag
- 2.8 Lugttærskel
- 2.9 Kogepunkt
- 2.10 Smeltepunkt
- 2.11 Opløselighed i vand
- 2.12 Opløselighed i organiske opløsningsmidler
- 2.13 Tæthed
- 2.14 Dampmassefylde
- 2.15 Stabilitet
- 2.16 Damptryk
- 2.17 Viskositet
- 2.18 Forbrændingsvarme
- 2.19 Fordampningsvarme
- 2.20 Overfladespænding
- 2.21 Brydningsindeks
- 2.22 Opbevaringstemperatur
- 2,23 pKa
- 3 Syntese
- 3.1 Fisher-reaktion
- 3.2 Tishchenko-reaktion
- 3.3 Andre metoder
- 4 anvendelser
- 4.1 Opløsningsmiddel
- 4.2 Kunstige smagsstoffer
- 4.3 Analyse
- 4.4 Organiske synteser
- 4.5 Kromatografi
- 4.6 Entomologi
- 5 risici
- 6 Referencer
Struktur af ethylacetat
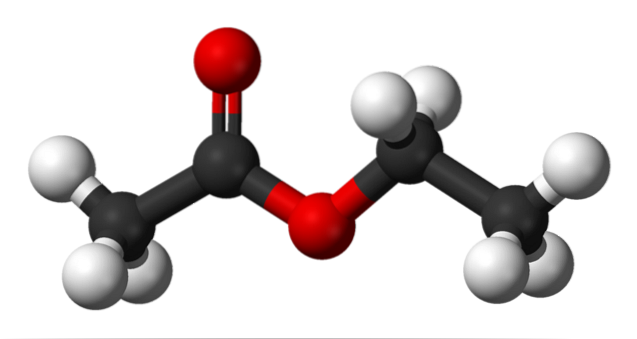
Det øverste billede viser strukturen af ethylacetat med en kugle- og stangmodel. I denne model er iltatomer fremhævet med røde kugler; til venstre er fraktionen afledt af syre og til højre fraktionen afledt af alkohol (alkoxygruppe, -OR).
Carbonylgruppen ses af C = O-bindingen (dobbeltbjælkerne). Strukturen omkring denne gruppe og det tilstødende ilt er fladt på grund af det faktum, at der er en delokalisering af ladningen ved resonans mellem begge oxygener; en kendsgerning, der forklarer en relativt lav syreindhold af α-hydrogener (dem fra -CH-gruppen3, knyttet til C = O).
Ved at rotere to af sine bindinger favoriserer molekylet direkte, hvordan det interagerer med andre molekyler. Tilstedeværelsen af de to iltatomer og asymmetrien i strukturen giver det et permanent dipolmoment; som igen er ansvarlige for deres dipol-dipol-interaktioner.
For eksempel er elektrondensiteten højere nær de to iltatomer og falder betydeligt i -CH-gruppen.3, og gradvist i OCH-gruppentoCH3.
På grund af disse interaktioner danner ethylacetatmolekyler en væske under normale forhold, som har et betydeligt højt kogepunkt (77 ° C)..
Fravær af hydrogenbindingsdonatomer
Hvis du ser nøje på strukturen, vil du bemærke fraværet af et atom, der er i stand til at donere en hydrogenbinding. Imidlertid er iltatomer sådanne acceptorer, og på grund af ethylacetat er det meget opløseligt i vand og interagerer i en estimerbar grad med polære forbindelser og hydrogenbindingsdonorer (såsom sukkerarter)..
Dette tillader det også at interagere fremragende med ethanol; grund til, at dets tilstedeværelse ikke går glip af alkoholholdige drikkevarer.
På den anden side gør dets alkoxygruppe det i stand til at interagere med visse apolære forbindelser, såsom chloroform, CH3Cl.
Fysiske og kemiske egenskaber
Navne
-Ethylacetat
-Ethylethanoat
-Ethyleddikesyreester
-Acetoxyethan
Molekylær formel
C4H8ELLERto eller CH3COOCtoH5
Molekylær vægt
88,106 g / mol.
Fysisk beskrivelse
Klar farveløs væske.
Farve
Farveløs væske.
Lugt
Karakteristisk for ethere, der minder om lugten af ananas.
Smag
Behagelig når det er fortyndet, tilføjer øl en frugtagtig smag.
Lugtgrænse
3,9 sider / min. 0,0196 mg / m3 (dårlig lugt) 665 mg / m3 (høj lugt).
Lugt påviselig ved 7-50 ppm (gennemsnit = 8 ppm).
Kogepunkt
171 ° F til 760 mmHg (77,1 ° C).
Smeltepunkt
-118,8 ºF (-83,8 ºC).
Vandopløselighed
80 g / l.
Opløselighed i organiske opløsningsmidler
Blandbar med ethanol og ethylether. Meget opløselig i acetone og benzen. Også blandbar med chloroform, faste og flygtige olier og også med iltede og chlorerede opløsningsmidler.
Massefylde
0,9003 g / cm3.
Dampmassefylde
3,04 (i luft: 1-forhold).
Stabilitet
Det nedbrydes langsomt med fugt; uforenelig med forskellige plastmaterialer og stærke oxidationsmidler. Blanding med vand kan være eksplosiv.
Damptryk
93,2 mmHg ved 25 ºC
Viskositet
0,423 mPoise ved 25 ºC.
Forbrændingsvarme
2.238,1 kJ / mol.
Fordampningsvarme
35,60 kJ / mol ved 25 ºC.
Overfladespænding
24 dyn / cm ved 20 ° C.
Brydningsindeks
1.373 ved 20 ºC / D.
Stuetemperatur
2 - 8 ºC.
pKa
16 - 18 ved 25 ºC.
Syntese
Fisher reaktion
Ethylacetat syntetiseres industrielt ved Fisher-reaktionen, hvor ethanol forestres med eddikesyre. Reaktionen udføres ved stuetemperatur.
CH3CHtoOH + CH3COOH <=> CH3COOCHtoCH3 + HtoELLER
Reaktionen accelereres ved syrekatalyse. Ligevægten skifter til højre, dvs. mod produktionen af ethylacetat, ved fjernelse af vand; i henhold til loven om masseaktion.
Tishchenko-reaktion
Ethylacetat fremstilles også industrielt under anvendelse af Tishchenko-reaktionen og konjugerer to ækvivalenter acetaldehyd med anvendelse af et alkoxid som katalysator..
2 CH3CHO => CH3COOCHtoCH3
Andre metoder
-Ethylacetat syntetiseres som et co-produkt ved oxidation af butan til eddikesyre i en reaktion udført ved en temperatur på 175 ° C og 50 atm tryk. Det bruges som en katalysator for cobalt og chromioner.
-Ethylacetat er et biprodukt fra ethanolysen af polyvinylacetat til polyvinylalkohol.
-Ethylacetat produceres også i industrien ved dehydrogenering af ethanol, hvilket katalyserer reaktionen ved anvendelse af kobber ved en høj temperatur, men under 250 ºC..
Ansøgninger
Opløsningsmiddel
Ethylacetat bruges som et opløsningsmiddel og fortyndingsmiddel, der bruges i rengøringskredsløb. Det bruges som opløsningsmiddel til fremstilling af modificeret humleekstrakt og ved koffeinfri kaffe og teblade. Det bruges i blæk, der bruges til at markere frugt og grøntsager.
Ethylacetat anvendes i tekstilindustrien som rengøringsmiddel. Det bruges til kalibrering af termometre, der bruges til adskillelse af sukker. I malingsindustrien bruges det som opløsningsmiddel og fortynder til de anvendte materialer..
Kunstige smag
Det bruges til produktion af frugtsmag; for eksempel: banan, pære, fersken og ananas samt druearoma osv..
Analytics
Det bruges til bestemmelse af vismut, bor, guld, molybdæn og platin samt et opløsningsmiddel til thallium. Ethylacetat har evnen til at ekstrahere mange forbindelser og grundstoffer, der er til stede i vandig opløsning, såsom: fosfor, cobalt, wolfram og arsen.
Organiske synteser
Ethylacetat anvendes i industrien som en viskositetsreduktionsmiddel til harpikser, der anvendes i fotoresistformuleringer. Anvendes til produktion af acetamid, acetylacetat og methylheptanon.
Kromatografi
Ethylacetat anvendes i laboratorier som den mobile fase af søjlekromatografi og som et ekstraktionsopløsningsmiddel. Da ethylacetat har et relativt lavt kogepunkt, er det let at fordampe, så stofferne opløst i opløsningsmidlet koncentreres.
Entomologi
Ethylacetat bruges i entomologi til at kvæle insekter, der er anbragt i en beholder, så de kan indsamles og undersøges. Ethylacetatdampe dræber insektet uden at ødelægge det og forhindre det i at hærde, hvilket letter dets samling til opsamling..
Risici
-LDhalvtreds af ethylacetat i rotter indikerer lav toksicitet. Det kan dog irritere hud, øjne, hud, næse og hals..
-Eksponering for høje niveauer kan forårsage svimmelhed og besvimelse. Ligeledes kan langvarig eksponering påvirke leveren og nyrerne..
-Indånding af ethylacetat i en koncentration på 20.000 - 43.000 ppm kan forårsage lungeødem og blødning..
-Den erhvervsmæssige eksponeringsgrænse er fastsat af OSHA til 400 ppm i luft, i gennemsnit over en 8-timers arbejdsskift..
Referencer
- Steven A. Hardinger. (2017). Illustreret ordliste for organisk kemi: ethylacetat (EtOAc). Gendannet fra: chem.ucla.edu
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10th udgave.). Wiley plus.
- Morrison, R. T. og Boyd, R. N. (1990). Organisk kemi. (5ta udgave). Redaktionel Addison-Wesley Iberoamericana.
- Wikipedia. (2019). Ethylacetat. Gendannet fra: en.wikipedia.org
- Bomuld S. (s.f.). Ethylacetat. Gendannet fra: chm.bris.ac.uk
- PubChem. (2019). Ethylacetat. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Newseed Chemical. (2018). Anvendelser og anvendelser af ethylacetat. Gendannet fra: foodsweeteners.com
- New Jersey Department of Health of Senior Services. (2002). Ethylacetat. [PDF]. Gendannet fra: nj.gov


Endnu ingen kommentarer