
Natriumacetatstruktur, egenskaber, syntese, anvendelser

Det Natriumacetat er et natriumsalt af eddikesyre, hvis molekylformel er CtoH3ELLERtoNa. Den består af et delikatenshvidt pulver, der i det væsentlige er til stede i to former: vandfri og trihydratiseret. Begge er meget opløselige i vand, det universelle opløsningsmiddel; men ikke så opløselig i alkoholer eller acetone.
Den vandfrie form har en densitet, et smeltepunkt og et kogepunkt med højere værdier end dem, der præsenteres af trihydratformen af natriumacetat. Dette skyldes, at vandmolekylerne interfererer mellem interaktionerne mellem Na-ionerne.+ og CH3COO-.

Natriumacetat er stabilt, især når det opbevares mellem 2 og 8 ° C; men det er modtageligt for virkningen af stærke oxidationsmidler og halogener.
Det kan fremstilles ved omsætning af natriumbicarbonat med eddikesyre. Også med omsætning af eddikesyre med natriumhydroxid. Begge reaktioner er enkle at producere og billige; den første kan endda gøres derhjemme.
Dette salt er en lavtoksisk forbindelse. Producerer hudirritation, kun efter hyppig og kontinuerlig kontakt. Det er let irriterende for øjnene, men kan irritere luftvejene. Der er ingen oplysninger om en skadelig virkning af dets indtagelse..
Det har adskillige anvendelser og anvendelser, der fremhæver dets pH-bufferingsfunktion sammen med eddikesyre. Acetatbufferen har en pKa = 4,7; hvilket giver høj effektivitet ved pH-regulering i et surt miljø med pH-værdier mellem 3 og 6.
På grund af dets lave toksicitet og dets egenskaber er det blevet brugt i vid udstrækning til at forbedre smagen af mad såvel som et middel, der giver beskyttelse mod ødelæggelse på grund af dets virkning mod mikrober..
Artikelindeks
- 1 Struktur af natriumacetat
- 1.1 Hydrerede krystaller
- 2 egenskaber
- 2.1 Navne
- 2.2 Molær masse
- 2.3 Udseende
- 2.4 Lugt
- 2,5 Massefylde
- 2.6 Smeltepunkt
- 2.7 Kogepunkt
- 2.8 Opløselighed
- 2.9 Surhed
- 2.10 Grundlæggende
- 2.11 Brydningsindeks (ηD)
- 2.12 Kalorieevne
- 2.13 Flammepunkt
- 2.14 Selvantændelsestemperatur
- 2,15 pH
- 2.16 Stabilitet
- 2.17 Reaktioner
- 3 Syntese
- 4 anvendelser
- 4.1 Termiske poser
- 4.2 Industriel
- 4.3 Medicinsk anvendelse
- 4,4 pH-bufferopløsning
- 4.5 Forskningslaboratorier
- 4.6 Konservering af fødevarer
- 4.7 Konservering af beton
- 5 Eksperimenter for unge mennesker
- 5.1 Eksperiment 1
- 5.2 Eksperiment 2
- 6 Toksicitet
- 7 Referencer
Struktur af natriumacetat
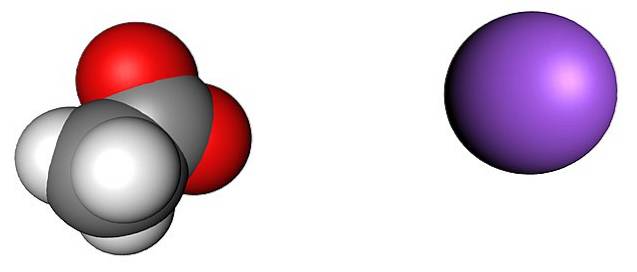
Billedet ovenfor viser de ioner, der udgør vandfri natriumacetatkrystaller (uden vand). Den lilla kugle svarer til Na-kationen+, og den molekylære ion til venstre er acetat, CH3COO-, med iltatomer repræsenteret af røde kugler.
Disse par ifølge formlen CH3COONa er i forholdet 1: 1; for hver CH-anion3COO-, der skal være en Na-kation+ tiltrukket af dets negative ladning og omvendt. Således ender tiltrækningerne mellem dem og frastødningen mellem lige ladninger med at etablere strukturelle mønstre, der definerer en krystal, hvis mindste udtryk er enhedscellen.
Nævnte enhedscelle, ligesom krystallen som helhed, varierer afhængigt af ionernes placering i rummet; det er ikke altid det samme, selv for det samme krystallinske system. For eksempel kan vandfrit natriumacetat danne to orthorhombiske polymorfe, hvoraf den ene er afbildet nedenfor:
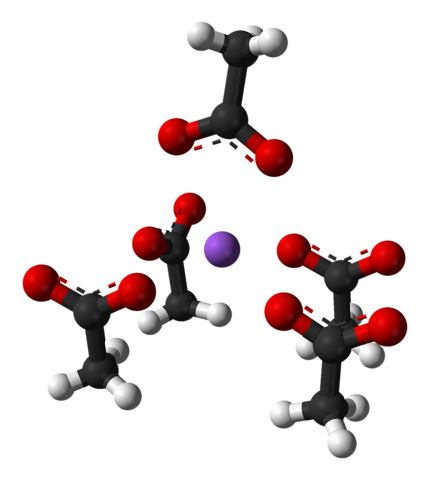
Bemærk ionernes placering: fire CH-ioner3COO- de låser en Na op+ på en sådan måde, at de "tegner" en forvrænget firkantbaseret pyramide. Hver af disse kap3COO- til gengæld interagerer de med en anden Na+ tilstødende.
Hydrerede krystaller
Natriumacetat har en høj affinitet for vand; faktisk er det delikat, dvs. det bibeholder fugt, indtil det opløses i det. Jo højere fugtighed, jo hurtigere "smelter" den. Dette skyldes, at både CH3COO- ligesom Na+ kan hydrere, omgive sig med vandmolekyler, der orienterer deres dipoler mod deres ladninger (Na+ Åhto, CH3COO- HOH).
Når dette salt fremstilles i laboratoriet eller derhjemme, er dets affinitet for vand sådan, at det allerede ved normale temperaturer allerede opnås som et hydrat; CH3COONa 3HtoO. Dens krystaller holder op med at være orthorhombiske og bliver monokliniske, da de nu inkorporerer tre vandmolekyler til hvert CH-par3COO- og Na+.
Ejendomme
Navne
-Natriumacetat.
-Natriumethanoat (IUPAC).
Molar masse
-Vandfri: 82,03 g / mol.
-Trihydrat: 136,03 g / mol.
Udseende
Deliquescent hvidt pulver.
Lugt
Til eddike, når den opvarmes til nedbrydning.
Massefylde
-Vandfri: 1,528 g / cm3 ved 20 ºC.
-Trihydrat: 1,45 g / cm33 ved 20 ºC.
Smeltepunkt
-Vandfri: 324 ºC (615 ºF, 597 K).
-Trihydrat: 58 ºC (136 ºF, 331 K).
Kogepunkt
-Vandfri: 881,4 ºC (1.618,5 ºF, 1.154,5 K).
-Trihydrat: 122 ° C (252 ° F, 395 K). Det nedbrydes.
Opløselighed
I vand
-Vandfri: 123,3 g / 100 ml ved 20 ° C.
-Trihydrat: 46,4 g / 100 ml ved 20 ºC.
I methanol
16 g / 100 g ved 15 ºC.
I ethanol
5,3 g / 100 ml (trihydrat).
I acetone
0,5 g / kg ved 15 ° C.
Surhed
pKa: 24 (20 ºC).
Grundlæggende
pKb: 9,25. Her fremgår det, at natriumacetat er et basisk salt, fordi det har pKb mindre end dets pKa.
Brydningsindeks (ηD)
1.464
Kalorikapacitet
-100,83 J / mol K (vandfri).
-229,9 J / mol K (trihydrat).
antændelsespunkt
Over 250 ° C.
Selvantændelsestemperatur
600 ºC.
pH
8,9 (0,1 M opløsning ved 25 ° C).
Stabilitet
Stabil. Uforenelig med stærke oxidationsmidler og halogener. Følsom over for fugtighed.
Reaktioner
Natriumacetat kan danne en ester ved omsætning med et alkylhalogenid; for eksempel bromethan:
CH3COONa + BrCHtoCH3 => CH3COOCHtoCH3 + NaBr
Natriumacetat-decarboxylater til methan (pyrolyse) i nærværelse af NaOH:
CH3COONa + NaOH => CH4 + NatoCO3
Reaktionen katalyseres af cæsiumsalte.
Syntese
Natriumacetat kan produceres billigt i laboratoriet ved omsætning af natriumbicarbonat med eddikesyre:
NaHCO3 + CH3COOH => CH3COONa + HtoCO3
Denne reaktion ledsages af tilstedeværelsen i opløsningen af en intens bobling på grund af nedbrydning af kulsyre i vand og kuldioxid..
HtoCO3 => HtoO + COto
Industrielt fremstilles natriumacetat ved omsætning af eddikesyre med natriumhydroxid.
CH3COOH + NaOH => CH3COONa + HtoELLER
Ansøgninger
Termiske poser
Natriumacetat anvendes til fremstilling af termiske poser.
Oprindeligt opløses saltkrystallerne i et volumen vand for at fremstille en opløsning, der bliver overmættet..
Derefter opvarmes opløsningen til en temperatur højere end 58 ºC, hvilket er dens smeltepunkt. Den overmættede opløsning får lov til at afkøle til stuetemperatur, og krystaldannelse observeres ikke; opløsningen er superkølet.
Fraværet af krystaller forklares ved, at væskens molekyler er for uordnede og ikke har den rette retning til at nå krystallisationstemperaturen. Væsken er i en metastabil tilstand, en tilstand af ubalance.
I betragtning af ustabiliteten af den superkølede væske er enhver forstyrrelse tilstrækkelig til at igangsætte krystallisation. I tilfælde af termiske poser presses en mekanisk fastgørelse for at omrøre væsken og indlede dannelsen af krystaller og størkningen af natriumacetat-trihydratopløsningen..
Når krystallisation opstår, stiger temperaturen. Natriumacetattrihydratkrystaller ser ud til is, men de er varme, hvorfor det kaldes "varm is.".
Industriel
-Natriumacetat anvendes i tekstilindustrien som en mordant i stoffarvningsprocessen
-Neutraliserer svovlsyreaffald
-Det bruges til forarbejdning af bomuld til produktion af bomuldspuder, der kan bruges til personlig rengøring og til medicinske formål
-Det bruges til bejdsning af metaller inden forkromning
-Samarbejder, så chloroprenvulkanisering ikke forekommer i fremstillingsprocessen for syntetisk gummi
-Går ind i oprensningen af glukose
-Det bruges til garvning af læder.
Medicinsk brug
Natriumacetat er en af de forbindelser, der bruges til at levere elektrolytter givet til patienter intravenøst..
Det bruges til at korrigere natriumniveauer hos hyponatremiske patienter, også til korrektion af metabolisk acidose og alkalisering af urinen..
PH bufferopløsning
Det bruges som en pH-regulator i mange enzymatiske reaktioner, der forekommer mellem pH 3 og pH 6.
Den forskellige pH i acetatbufferopløsningen nås ved variationen i koncentrationen af eddikesyre og natriumacetat..
For eksempel for at opnå en pH 4,5 har bufferopløsningen således en eddikesyrekoncentration på 3,8 g / L og en vandfri natriumacetatkoncentration på 3,0 g / L..
Koncentrationen af acetatbufferen kan øges, idet der i samme andel øges de komponenter i opløsningen, der er nødvendige for at opnå den ønskede pH.
Acetat / acetonitrilbuffer anvendes i kapillærelektroforese til adskillelse af fotoberberiner.
Forskningslaboratorier
-Natriumacetat er et svagt nukleofilt middel, der anvendes til den anioniske polymerisation af β-lacton.
-Det bruges som et reagens i den nukleare magnetiske resonans af biologiske makromolekyler.
-Det bruges til ekstraktion af DNA fra celler. Natrium er en kation, der interagerer med de negative ladninger af fosfater, der findes i DNA, hvilket hjælper med deres kondens. I nærværelse af ethanol danner DNA et bundfald, som derefter kan separeres i det vandige lag.
Madopbevaring
-Hjælper med at forhindre bakterievækst ud over at forhindre dannelsen af overskydende surhed, der forårsager madspild, og opretholder således en bestemt pH.
-Natrium til stede i acetat forbedrer smagen af mad.
-Natriumacetat bruges til fremstilling af syltede grøntsager: agurk, gulerod, løg osv. Derudover bruges det til konservering af kød.
Opbevaring af beton
Beton beskadiges af vandets virkning, hvilket forkorter varigheden. Natriumacetat fungerer som et betonforseglingsmiddel, der gør det vandtæt og forlænger dets oprindelige egenskaber.
Ungdomseksperimenter
Eksperiment 1
Et simpelt eksperiment er syntesen af natriumacetat ved omsætning af natriumbicarbonat med eddike (5% eddikesyre).
30 ml eddike anbringes i et bægerglas, og der tilsættes ca. 3,5 g bicarbonat..
Natriumacetat og kulsyre dannes i reaktionen. Syre nedbrydes til kuldioxid og vand. Dannelsen af kuldioxid vil producere en intens bobling i opløsningen.
For at opsamle natriumacetatet fordamper vandet og opvarmer opløsningen.
Eksperiment 2
Et andet simpelt eksperiment er dannelsen af krystaller af natriumacetattrihydrat.
For at gøre dette afvejes ca. 20 g natriumacetattrihydrat og anbringes i et bægerglas, derefter tilsættes 10 ml vand. Opløsningen opvarmes til en temperatur over 58 ºC.
Natriumacetat opløses fuldstændigt for at sikre, at opløsningen er overmættet. Tidligere placeres en Pietri-skål på en kold overflade.
Indholdet af bægerglasset med acetattrihydratet hældes langsomt i Pietri-skålen. Væskens temperatur i kapslen begynder at falde, selv under smeltepunktet uden at observere krystallisationen eller størkningen af natriumacetattrihydratet..
For at frembringe krystallisation af natriumacetat-trihydratet tilsættes sædvanligvis en lille mængde salt til at tjene som krystalliseringskerne. Andre gange opstår der en lille forstyrrelse af opløsningen for at starte krystallisationen af natriumacetat.
Natriumacetattrihydratkrystaller ser ud som is, men hvis du rører ved dem, vil du bemærke, at de er relativt varme. Af denne grund kaldes salt "varm is".
Toksicitet
Natriumacetat er en meget lav toksisk forbindelse. Det er heller ikke klassificeret som hud- og luftvejssensibilisator..
Derudover er natriumacetat ikke klassificeret som et kimcelle-mutagent, kræftfremkaldende eller reproduktionstoksisk middel..
Kort sagt er det let irriterende for øjnene. Luftvejene kan irritere efter indånding. Hyppig og konstant kontakt med huden kan forårsage irritation.
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- WorldOfChemicals. (16. januar 2017). Hvordan tilberedes natriumacetat derhjemme? Gendannet fra: medium.com
- National Center for Biotechnology Information. (2019). Natriumacetat. PubChem-database. CID = 517045. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- S. Cameron, K. M. Mannan og M. O. Rahman. (1976). Krystalstrukturen af natriumacetat-trihydrat. Acta Cryst. B32, 87.
- Wikipedia. (2019). Natriumacetat. Gendannet fra: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (24. januar 2019). Lav varm is af eddike og bagepulver. Gendannet fra: thoughtco.com
- Kemikaliebog. (2017). Natriumacetat. Gendannet fra: chemicalbook.com
- Wasserman Robin. (2019). Anvendelse af natriumacetat. Gendannet fra: livestrong.com
- Drugbank. (2019). Natriumacetat. Gendannet fra: drugbank.ca


Endnu ingen kommentarer