
Adiponectin struktur, funktion, receptorer, virkningsmekanisme
Det adiponectin det er et af de mest udbredte sekretoriske proteiner produceret af en speciel type celler kendt som adipocytter, der er karakteristisk for fedtvæv. Det er ansvarligt for at øge følsomheden over for insulin og er involveret i energihomeostase og fedme.
Det humane adiponectin-gen blev klonet fra fedtvæv i 1996 under eksperimenter af Matsuzawa, der kaldte det det mest rigelige fedtgen-transkript-1 (apM1). fedtfattig mest gentranskript 1).
Proteinet blev derimod identificeret i blodplasma samme år af Nakano et al..
Dette hormon bidrager til integrationen af endokrine og metaboliske signaler, der er relateret til styring af energihomeostase. Dets ekspression induceres under adipocytdifferentiering og cirkulerer i serum ved relativt høje koncentrationer..
Artikelindeks
- 1 Struktur
- 2 Funktion
- 3 modtagere
- 3.1 T-cadherin
- 4 Handlingsmekanisme
- 5 Normale værdier
- 6 Referencer
Struktur
Adiponectin tilhører komplement-1q (C1q) -familien og kan findes i blodplasma i en lang række multimere komplekser (af flere underenheder): trimere, hexamerer og multimerer med høj molekylvægt (på mere end 18 underenheder).
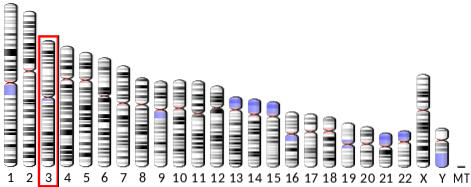
Genet, der koder for adiponectin (ADIPOQ) er placeret på den lange arm af kromosom 3 hos mennesker, har 16 kilo baser og har 3 eksoner. Dets udtryk giver et vandopløseligt protein, der består af 247 aminosyrerester og en molekylvægt på lige under 30 kDa med et isoelektrisk punkt på 5,42.
Den består af fire domæner: en signalsekvens ved den N-terminale ende, en variabel region, et kollagendomæne (cAd) og et globulært C-terminalt domæne..
I den aminoterminale del skelnes der mellem en kollagenlignende sekvens kendt som collagendomænet, hvilket er en region af stor betydning for dannelsen af multimerer og er stærkt konserveret mellem arter.
Hydroxyleringen og den samtidige glycosylering af lysinrester i dette proteins kollagendomæne er det, der muliggør dannelsen af trimerer, som samtidig kan associeres med hinanden for at danne hexamerer og andre komplekser med høj molekylvægt..
Disse komplekser har tilsyneladende "mål" vævsspecificitet, for eksempel er komplekser med høj molekylvægt mere aktive i leveren, mens trimere og hexamerer virker uden særlig forskel i en lang række væv..
Det kugleformede område ved C-terminalen, kaldet det kugleformede domæne eller gAd, er homologt med proteiner, såsom collagen VIII og kollagen X, såvel som komplementfaktor C1q..
Fungere
Generelt menes det, at hormonet adiponectin virker på en relevant måde i reguleringen af metabolismen af lipider og kulhydrater i forskellige insulinfølsomme væv..
Dette virker på forskellige kropsvæv, da dets receptorer udtrykkes flere steder. Adiponectin, der udelukkende er produceret af adipocytter, fremmer biosyntese af fedtsyrer og inhibering af gluconeogenese i leveren, et af vævene, hvor dens AdipoR2-receptor findes..
I skeletmuskulatur, hvor AdipoR1- og AdipoR2-receptorer findes, fremmer det oxidationen af fedtsyrer og indgangen af glukose i muskelcellerne.
Adiponectin forbedrer også insulinresistens hos nogle patienter, da det reducerer mængden af intracellulært fedt ved at aktivere oxidationen af fedtsyrer i både muskler og lever..
Visse forfattere antyder, at dette hormon også fungerer som en antioxidant, som et antiinflammatorisk middel og som en anti-arteriosklerotisk faktor.
Modtagere
De forskellige adiponectinkomplekser ser ud til at have en vis præference over specifikt væv. Disse vævsspecifikke interaktioner forekommer som reaktion på den forskellige ekspression af forskellige typer adiponectinreceptorer..
Adiponectin-receptorer (AdipoR) er G-proteinkoblede receptorer, der hører til familien af receptorer kendt som PAQR. Der kendes to typer: AdipoR1 og AdipoR2. Begge bevarer deres N-terminale domæner i det intracellulære rum, mens deres C-terminale domæner udsættes for det ekstracellulære rum..
Receptorer af AdipoR1-typen har 375 aminosyrer og 42 kDa molekylvægt, mens receptorer af AdipoR2-typen har 311 aminosyrer og en vægt på 35 kDa. Begge har 7 transmembrane domæner, det vil sige, deres struktur krydser plasmamembranen i cellerne, hvor de findes 7 gange..
Der er ca. 70% sekvenshomologi mellem begge receptorer med undtagelse af deres N-terminale ender, som er specifikke for hver enkelt..
Både AdipoR1 og AdipoR2 udtrykkes i alle væv, skønt deres overflod varierer fra den ene til den anden. AdipoR1 er primært i skeletmuskulatur, og AdipoR2 er i både skeletmuskulatur og lever.
T-cadherin
Der er også en "formodet" receptor for adiponectin kendt som T-cadherin, som består af et enkelt cadherinmolekyle, der har mistet sit cytosoliske og transmembrane domæner og er bundet til celleoverfladen gennem glycosylphosphatidylinositolankre (GPI-ankre).
Denne adiponectin “receptor” udtrykkes i alle væv, men det er blevet rapporteret med større forekomst i hjertet, i aorta, halspulsåren og iliacarterierne og i nyrearterierne..
Handlingsmekanisme
Selvom mekanismerne til produktion af adiponectin og frigivelse i blodbanen ikke forstås fuldt ud, menes det, at signaltransduktionsvejen begynder med adiponectin-binding til membranreceptorer på dens målceller..
Dette hormon inducerer aktivering af AMP-aktiveret proteinkinase (AMPK), som forekommer gennem et "adapter" -protein, der indeholder et domæne for homologi med pleckstrin (typisk for proteiner involveret i cellesignaliseringsprocesser) og et domæne af phosphotyrosinbinding (PTB) , plus et leucin-lukningsmotiv 1 (APPL).
APPL-domænet er det, der binder til den intracellulære del af en af de to AdipoR-receptorer. Et lille GTPase-protein kendt som Rab5 binder sig til et af stedene i det leucin-lukningsdomæne og fremmer membrantranslokation af GLUT4, en insulinreguleret glukostransportør..
Derudover virker adiponectin på en nuklear transkriptionsfaktor kendt som PPARa, hvilket er vigtigt set fra et protein-, lipid- og kulhydratmetabolisme samt celledifferentiering og -udvikling..
Normale værdier
De normale rapporterede værdier for adiponectin i blodplasma svarer til multimere komplekser af dette protein, hvis koncentrationsområde er mellem 5 og 20 mikrogram pr. Milliliter, skønt koncentrationer på op til 30 mikrogram pr. Milliliter også er blevet dokumenteret..
I betragtning af ovenstående er det værd at nævne, at adiponectinkoncentrationer i plasma varierer betydeligt; kvinder har for eksempel en tendens til at have højere værdier end mænd.
Værdierne for dette hormon afhænger i høj grad af ernæringsstatus, tilstedeværelsen eller fraværet af en hvilken som helst patologi osv., Men er generelt omvendt korreleret med fedme og med tilstande såsom hjerte-kar-sygdomme, hypertension og metaboliske syndromer.
Der er rapporter, der sikrer, at plasmakoncentrationer af adiponectin falder hos de patienter, der lider af patologiske tilstande såsom insulinresistens og fedme..
Referencer
- Chandran, M., Phillips, S. A., Ciaraldi, T., og Henry, R. R. (2003). Adiponectin: mere end bare et andet fedtcellehormon? Diabetesbehandling, 26 (8), 2442-2450.
- Hirako, S. (2016). Adiponectin. I Håndbog om hormoner (s. 308-e34B). Akademisk presse.
- Kadowaki, T. og Yamauchi, T. (2005). Adiponectin og adiponectin receptorer. Endokrine anmeldelser, 26 (3), 439-451.
- Kadowaki, T., Yamauchi, T., Kubota, N., Hara, K., Ueki, K., og Tobe, K. (2006). Adiponectin og adiponectin receptorer i insulinresistens, diabetes og det metaboliske syndrom. The Journal of clinical study, 116 (7), 1784-1792.
- Klein, S. og Romijn, J. A. (2007). Kapitel 35-Fedme. Williams lærebog om endokrinologi, 11, 1568-1569.
- Steyn, F. J., & Chen, C. (2013). Adiponectin.


Endnu ingen kommentarer