
Allotropi Allotropisk transformation og hovedelementer

Det allotropi i kemi er det det kendetegn, som visse kemiske grundstoffer har, at de præsenterer sig i flere forskellige former, men i samme tilstand af sammenlægning af stof. Elementernes struktur kan variere afhængigt af deres molekylære arrangement og de betingelser, hvorunder de dannes, såsom tryk og temperatur..
Først når det kommer til kemiske grundstoffer, anvendes ordet allotropi, der betegner hver af måderne, hvorpå et element kan findes i samme fase som en allotrop; der henviser til, at det ikke gælder for forbindelser, der udviser forskellige krystallinske strukturer; i dette tilfælde kaldes det polymorfisme.
Andre tilfælde er kendt, såsom ilt, hvor allotropi kan forekomme som en ændring i antallet af atomer i stoffet. I denne forstand er der en forestilling om to allotroper af dette element, som er bedre kendt som ilt (Oto) og ozon (O3).
Artikelindeks
- 1 Allotropisk transformation
- 2 Hovedallotropiske elementer
- 2.1 Kulstof
- 2.2 Svovl
- 2.3 Fosfor
- 2.4 Oxygen
- 3 Referencer
Allotropisk transformation
Som tidligere nævnt er allotropes de forskellige måder, hvorpå det samme element kan findes, så denne variation i dets struktur får disse arter til at vises med forskellige fysiske og kemiske egenskaber..
Ligeledes sker den allotrope transformation mellem et element og et andet ved den måde, hvorpå atomer er arrangeret inden i molekylerne; det vil sige den måde, som linket stammer fra.
Denne ændring mellem en allotrop og en anden kan forekomme af forskellige årsager, såsom ændringer i forholdene for tryk, temperatur og endda forekomsten af elektromagnetisk stråling såsom lys..
Når strukturen af en kemisk art ændres, kan den også ændre dens adfærd, ændre egenskaber såsom dens elektriske ledningsevne, hårdhed (i tilfælde af faste stoffer), smelte- eller kogepunkt og endda fysiske kvaliteter såsom dens farve..
Derudover kan allotropi være af to typer:
- Monotropisk, når en af elementstrukturerne har større stabilitet end de andre under alle forhold.
- Enanthropisk, når de forskellige strukturer er stabile under forskellige forhold, men kan omdanne den ene til den anden på en reversibel måde ved bestemte tryk og temperaturer.
Vigtigste allotropiske elementer
Selvom der er mere end hundrede kendte elementer i det periodiske system, har ikke alle allotropiske former. De mest kendte allotroper er præsenteret nedenfor.
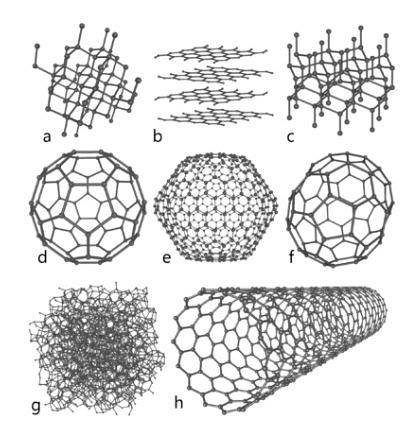
Kulstof
Dette element med stor overflod i naturen repræsenterer det grundlæggende grundlag for organisk kemi. Flere kendte arter af dette er kendt, blandt hvilke diamant, grafit og andre, der vil blive eksponeret nedenfor, skiller sig ud..
Diamant
Diamanten viser et molekylært arrangement i form af tetraedriske krystaller, hvis atomer er bundet af enkeltbindinger; dette betyder, at de er arrangeret ved hybridisering sp3.
Grafit
Grafit består af på hinanden følgende plader af kulstof, hvor dets atomer er forbundet i sekskantede strukturer ved dobbeltbindinger; med hybridisering spto.
Carbino
Ud over de to vigtige allotroper, der er nævnt ovenfor, og som er de mest kendte af kulstof, er der andre, såsom carbyne (som lineært acetylenisk kulstof, LAC, er også kendt), hvor dets atomer er arrangeret på en lineær måde gennem tredobbelte bindinger; med hybridisering sp.
Andre
- Grafen, hvis struktur ligner meget grafit).
- Fulleren eller buckminsterfulleren, også kendt som buckyball, hvis struktur er sekskantet, men dens atomer er arrangeret i form af en ring.
- Carbon nanorør, cylindriske i form.
- Amorft kulstof uden krystallinsk struktur.
Svovl
Svovl har også flere allotroper, der betragtes som almindelige, såsom følgende (det skal bemærkes, at alle disse er i fast tilstand):
Rhombisk svovl
Som navnet antyder, består dens krystallinske struktur af ottekantede romber og er også kendt som α svovl..
Monoklinisk svovl
Kendt som β-svovl, har den form af et prisme, der består af otte svovlatomer.
Smeltet svovl
Det producerer prismatiske krystaller, der er stabile ved bestemte temperaturer og danner nåle uden farve..
Plastisk svovl
Også kaldet svovl, det har en amorf struktur.
Flydende svovl
Det har viskositetsegenskaber i modsætning til de fleste af elementerne, da det i denne allotrope vokser med stigende temperatur.
Match
Dette ikke-metalliske element findes almindeligvis i naturen i kombination med andre grundstoffer og har flere tilknyttede allotrope stoffer:
Hvidt fosfor
Det er et fast stof med en tetraedrisk krystallinsk struktur og har anvendelser på det militære område, endda brugt som et kemisk våben..
Sort fosfor
Det har den højeste stabilitet blandt de allotropes af dette element og ligner meget grafen.
Rødt fosfor
Danner et amorft fast stof med reducerende egenskaber, men er blottet for toksicitet.
Diphosphor
Som navnet antyder, består den af to fosforatomer og er en gasform af dette element.
Violet fosfor
Det er et fast stof med en krystallinsk struktur med et monoklinisk molekylært arrangement..
Skarlagenrød fosfor
Også solid amorf struktur.
Ilt
På trods af at det er et af de mest almindelige elementer i jordens atmosfære og et af de mest rigelige elementer i universet, har det få kendte allotropes, blandt hvilke dioxygen og trioxygen skiller sig ud..
Dioxygen
Dioxygen er bedre kendt under det enkle navn ilt, et gasformigt stof, der er essentielt for de biologiske processer på denne planet..
Trioxygen
Trioxygen er bedre kendt som ozon, en meget reaktiv allotrop, hvis mest berømte funktion er at beskytte jordens atmosfære mod eksterne strålingskilder..
Tetraoxygen
Danner en solid fase af trigonal struktur med karakteristika for metastabilitet.
Andre
Der er også seks andre faste arter, som ilt dannes med forskellige krystallinske strukturer..
På samme måde er der elementer såsom selen, bor, silicium, blandt andre, der præsenterer forskellige allotroper, og som er blevet undersøgt med en mindre eller større dybde..
Referencer
- Wikipedia. (s.f.). Allotropi. Gendannet fra en.wikipedia.org
- Chang, R. (2007). Chemistry, niende udgave. Mexico: McGraw-Hill.
- Britannica, E. (s.f.). Allotropi. Hentet fra britannica.com
- ThoughtCo. (s.f.). Allotrope Definition og eksempler. Gendannet fra thoughtco.com
- Ciach, R. (1998). Avancerede lyslegeringer og kompositter. Hentet fra books.google.co.ve




Endnu ingen kommentarer