
Carbonototroper amorft kulstof, grafit, grafener, nanorør

Det carbon allotropes de er de forskellige fysiske former, hvor deres atomer kan arrangeres og forbindes. Hver enkelt svarer til et fast stof med sine egne specielle egenskaber. Molekylært og strukturelt adskiller de sig fra hinanden. Der er to hovedtyper af disse allotroper: krystallinsk og amorf..
Krystallinske allotroper er dem, der har et gentaget mønster af deres atomer i rummet. I mellemtiden er atomer arrangeret uordentligt i amorfe allotroper, uden at der er to identiske regioner i det faste stof. Så de første er bestilt, og de andre er rodet.
(https://creativecommons.org/licenses/by-sa/4.0)]
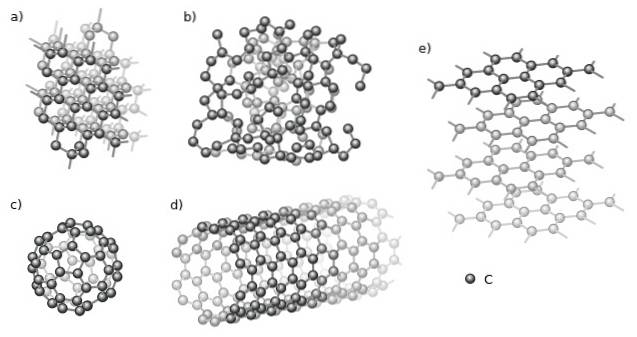
Blandt de krystallinske er diamant (a) og grafit (e) par excellence. Det observeres i det øverste billede forskellige strukturer, der har et fælles aspekt: de er kun sammensat af kulstofatomer (sorte kugler).
Og blandt de amorfe allotroper har vi det amorfe kulstof (b), som, som det kan ses, dets struktur er uordnet. Der er dog mange typer amorfe kulstoffer, så det er en familie af faste stoffer..
Også carbonatomer kan danne supramolekyler, såsom fullerener (c) og nanorør (d). Disse supramolekyler kan variere i størrelse og form, men de har de samme geometrier; sfæriske og rørformede til henholdsvis fullerener og nanorør.
Artikelindeks
- 1 Kovalente bindinger af kulstof
- 1.1 Sekskanter
- 1.2 Tetrahedra
- 2 amorft kulstof
- 2.1 Politik
- 2.2 Funktionelle grupper
- 3 Grafit
- 3.1 Fysiske egenskaber
- 4 grafen
- 5 Carbon nanorør
- 5.1 Strukturelle konformationer
- 6 Fullerener
- 7 Referencer
Kovalente bindinger af kulstof
Før vi tager fat på nogle af de kendte allotroper af kulstof, er det nødvendigt at gennemgå, hvordan kulstofatomer binder..
Ifølge valensbindingsteorien har kulstof fire elektroner i sin valensskal, hvormed de danner kovalente bindinger. Takket være elektronisk promovering og hybridisering kan de fire elektroner placeres i fire separate orbitaler, hvad enten de er rene eller hybrid.
Derfor har kulstof evnen til at danne op til maksimalt fire bindinger.
DC. Ved at have fire CC-bindinger når atomerne valensoktet, og de bliver meget stabile. Dette betyder dog ikke, at der ikke kun kan være tre af disse links, som dem der ses i sekskanter..
Sekskanter
Afhængig af hybridiseringerne af carbonatomet kan dobbelt- eller tredobbeltbindinger findes i strukturen af deres respektive allotroper. Men endnu tydeligere end eksistensen af sådanne bindinger er geometrien, som kulstofferne anvender.
For eksempel, hvis en sekskant observeres, betyder det, at kulstofferne har SP-hybridiseringto og derfor har en orbital s ren med en ensom elektron. Kan du se perfekte sekskanter i det første billede? De allotroper, der indeholder dem, antyder, at deres kulstoffer er spto, hvorvidt der er dobbeltbindinger (som f.eks. benzenringen).
Et maske-, plan- eller sekskantet lag består derefter af sp-carbonatomerto der har et elektronisk "loft" eller "sky", produkt af den uparrede elektron af orbitalen s. Denne elektron kan danne kovalente bindinger med andre molekyler eller tiltrække de positive ladninger af metalioner; ligesom K+ og Na+.
Ligeledes tillader disse elektroner, at disse skaller kan stables oven på hinanden uden binding (på grund af en geometrisk og rumlig hindring for overlapningen af de to orbitaler s). Dette betyder, at allotropes med sekskantede geometrier måske eller måske ikke beordres til at bygge en krystal..
Tetrahedra
Hvis der observeres en tetraeder, som det vil blive forklaret i sidste afsnit, betyder det, at kulstofferne har sp-hybridisering3. I dem er der fire enkelt-C-bindinger, og de danner et tetraedrisk krystalgitter. I sådan tetraeder er der ingen frie elektroner, som der er i sekskanter..
Amorft kulstof

Amorft kulstof kan forestilles som en slags porøs svamp med masser af vilkårligt arrangerede sekskantede og tetraedriske netværk. I denne mineralmatrix kan de fange andre elementer, som kan komprimere eller udvide svampen; og på samme måde kan dets strukturelle kerner være større eller mindre.
Afhængig af% carbon afledes således forskellige typer amorfe carbonatomer; såsom sod, trækul, antracit, kønrøg, tørv, koks og aktivt kul.
Ved første øjekast ser de alle eksternt ud (øverste billede) med graderinger til kanten af sorte, kedelige eller metalliske og grålige overtoner..
Ikke alle amorfe kulstoffer har samme oprindelse. Vegetabilsk kulstof er, som navnet antyder, et produkt af forbrænding af vegetabilske masser og træ. Mens kønrøg og koks er produkter i forskellige faser og betingelser for olieprocesser..
Selvom de ikke synes meget attraktive, og det kan antages, at de kun tjener som brændstoffer, tiltrækker porøsiteten af deres faste stoffer opmærksomhed i teknologiske oprensningsanvendelser, såsom opbevaring af absorbenter og stoffer og også som katalytiske bærere..
Politypism
Strukturerne af amorfe carbonatomer er komplekse og uordnede; men krystallografiske undersøgelser har vist, at de i virkeligheden er tetraedriske (diamant) og sekskantede (grafit) polytyper, arrangeret vilkårligt i lag.
For eksempel, hvis T og H er henholdsvis de tetraedriske og sekskantede lag, kan et amorft carbon strukturelt beskrives som: THTHHTH; eller HTHTTHTHHHT osv. Visse T- og H-lagsekvenser definerer en type amorf carbon; men inden i dem er der ingen gentagne tendenser eller mønstre.
Det er af denne grund, at det er strukturelt vanskeligt at karakterisere disse kulstofallotroper; og i stedet for det foretrækkes dets% kulstof, som er en variabel, der letter dens forskelle ud over dets fysiske egenskaber og dens tendens til at brænde eller brænde.
Funktionelle grupper
Det blev nævnt, at sekskantede planer har en ikke-parret elektron, hvormed den kan danne en binding med andre molekyler eller atomer. Hvis de omgivende molekyler for eksempel er HtoO og COto, Det kan forventes, at der dannes henholdsvis OH- og COOH-grupper. De kan også binde til hydrogenatomer og danne CH-bindinger..
Mulighederne er meget varierede, men sammendrag kan amorfe carbonatomer være vært for iltede funktionelle grupper. Når disse heteroatomer er til stede, er de ikke kun placeret på kanterne af flyene, men også og endda indeni.
Grafit

Billedet ovenfor viser en model med kugler og strenge af den krystallinske struktur af grafit. Heldigvis hjælper skyggene på kuglerne med at visualisere π skyerne som et resultat af delokaliseringen af deres uparrede elektroner. Dette blev nævnt i det første afsnit uden så mange detaljer.
Disse π skyer kan sammenlignes med to systemer: benzenringe og "elektronhav" i metalliske krystaller..
Orbitaler s de slutter sig til hinanden for at bygge et spor, hvor elektroner bevæger sig frit; men kun mellem to sekskantede lag; vinkelret på dem er der ingen strøm af elektroner eller strøm (elektronerne skal passere gennem kulstofatomer).
Da der er en konstant migration af elektroner, dannes øjeblikkelige dipoler konstant, som inducerer andre dipoler af carbonatomer, der er over eller under; lagene eller arkene af grafit forbliver sammen takket være Londons spredningskræfter..
Disse sekskantede lag skaber som forventet en sekskantet grafitkrystal; eller rettere en række små krystaller forbundet i forskellige vinkler. Π-skyerne opfører sig som om de var et "elektrisk smør", hvilket gjorde det muligt for lagene at glide før nogen ekstern forstyrrelse på krystallerne.
Fysiske egenskaber
De fysiske egenskaber ved grafit er lette at forstå, når dens molekylære struktur er blevet behandlet..
For eksempel er grafits smeltepunkt meget højt (over 4400 ° C), fordi den energi, der tilføres i form af varme, skal uigenkaldeligt adskille de sekskantede lag og også bryde deres sekskanter..
Det blev netop sagt, at deres lag kan glide over hinanden; Og ikke kun, men de kan også havne oven på andre overflader, såsom den cellulose, der udgør papiret, når det aflejres fra blyantens grafit. Denne egenskab gør det muligt for grafit at fungere som et glimrende smøremiddel..
Og som allerede nævnt er det en god leder af elektricitet og også af varme og lyd..
Grafener

Selvom det ikke blev vist i det første billede, kan denne kulstofallotrop ikke udelades. Antag, at grafitlagene blev grebet og kondenseret til et enkelt ark, der var åbent og dækkede et stort område. Hvis dette blev gjort molekylært, ville der blive født grafener (øverste billede).
Så grafen er et individuelt grafitisk ark, der ikke interagerer med andre og kan bølge som et flag. Bemærk, at det ligner væggene i biernes bikager.
Disse grafenark bevarer og multiplicerer grafitens egenskaber. Dets sekskanter er meget vanskelige at adskille, hvorfor de præsenterer en dybtgående mekanisk modstand; endnu højere end stål. Derudover er de ekstremt lette og tynde, og teoretisk set ville et gram af dem være nok til at dække en hel fodboldbane..
Hvis du ser på det øverste billede igen, kan du se, at der ikke er dobbeltbindinger. Bestemt kan der være dem såvel som tredobbelte bindinger (graffiner). Det er her, at grafens kemi åbner sig, siger.
Ligesom grafit og de andre sekskantede lag kan andre molekyler binde kovalent til overfladen af grafen og funktionalisere dets struktur til elektroniske og biologiske anvendelser..
Carbon nanorør
Antag nu, at vi greb grafenarkene og begyndte at rulle dem ind i et rør; Disse er carbon-nanorørene. Længderne og radius af disse rør er variable, ligesom deres rumlige konformationer. Sammen med grafen og fullerener udgør disse nanorør triaden af de mest overraskende kulstofallotroper.
Strukturelle konformationer
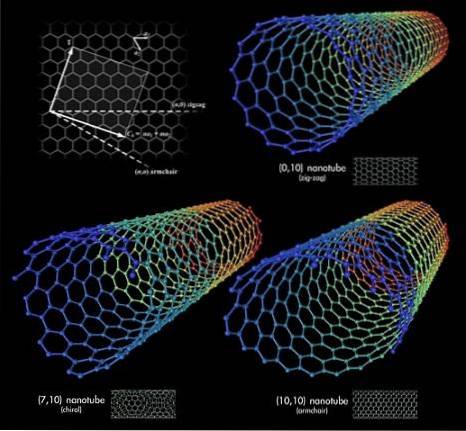
Tre nanorør med kulstof er vist i det øverste billede. Hvad er forskellen mellem dem? Alle tre har sekskantede mønstrede vægge og udviser de samme diskuterede overfladeegenskaber. Svaret ligger så i de relative retninger af disse sekskanter.
Den første konformation svarer til zigzag-typen (øverste højre hjørne). Hvis du kigger nøje, vil du se, at den har rækker af sekskanter placeret perfekt vinkelret på rørets længdeakse..
I modsætning hertil til typekonformation lænestol, eller stol (nederste højre hjørne), er sekskanterne anbragt i rækker i samme retning som rørets længdeakse. I det første nanorør løber sekskanterne over overfladen i betydningen af dens diameter, og i det andet nanorør løber de langs overfladen fra "ende til ende".
Og endelig er der den chirale nanorør (nederste venstre hjørne). Sammenlign en vindeltrappe, der går til venstre eller højre. Det samme sker med denne kulstofnanorør: dens sekskanter er arrangeret stigende til venstre eller højre. Da der er to rumlige versioner, siges det så, at det udviser chiralitet.
Fullerener
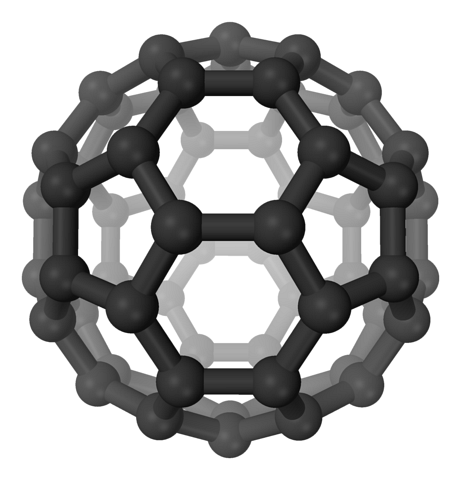
I fullerenerne opretholdes sekskanterne stadig, men derudover vises femkantene, alle med sp carbonatomerto. Arkene eller lagene er allerede efterladt: nu er de blevet foldet på en sådan måde, at de danner en bold, der ligner en fodbold; og afhængigt af antallet af kulstoffer, til en rugbybold.
Fullerener er molekyler, der adskiller sig i størrelse. Den mest berømte er C60 (øverste billede). Disse kulstofallotroper skal behandles som balloner, som kan presses sammen for at danne krystaller, hvor ioner og andre molekyler kan fanges inden i deres mellemrum..
Disse kugler er specielle bærere eller understøtninger til molekyler. Hvordan? Gennem de kovalente bindinger til overfladen, især til de tilstødende kulstoffer i en sekskant. Fulleren siges derefter at være blevet funktionaliseret (en exohedral addukt).
Dens vægge kan brydes strategisk for at opbevare molekyler indeni; ligner en sfærisk kapsel. Disse kugler kan også have revner og funktionaliseres på samme tid; alt afhænger af den applikation, de er beregnet til.
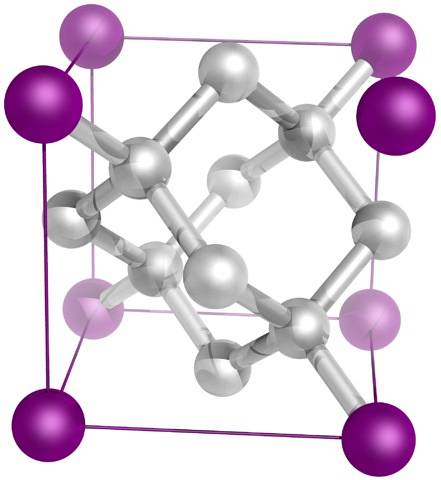
Og endelig den mest kendte af alle allotropes af kulstof: diamant (selvom ikke alle er kulstof).
Strukturelt består den af kulstofatomer sp3, danner fire CC-bindinger og et tredimensionelt netværk af tetraeder (øverste billede), hvis krystallinske celle er kubisk. Det er det hårdeste af mineraler, og dets smeltepunkt er tæt på 4000ºC..
Dens tetraeder er i stand til at overføre varme effektivt gennem krystalgitteret; men ikke så med elektricitet, fordi dets elektroner er meget godt placeret i dens fire kovalente bindinger, og det kan ikke gå nogen steder. Derfor er det en god termisk leder, men det er en elektrisk isolator..
Afhængigt af hvordan det er facetteret, kan det sprede lys i mange lyse og attraktive vinkler, hvorfor de er eftertragtede som ædelsten og smykker..
Netværket er meget modstandsdygtigt, fordi det har brug for et stort pres for at flytte dets tetraeder. Denne egenskab gør det til et materiale med høj mekanisk modstand og hårdhed, der er i stand til at foretage præcise og rene snit, som med en skalpel med diamantspids..
Deres farver afhænger af deres krystallografiske defekter og deres urenheder.
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Méndez Medrano, Ma. Guadalupe, Rosu, H. C., Torres González, L. A. (2012). Grafen: den mest lovende allotrop af kulstof. Universitetsloven. vol. 22, nr. 3, april-maj, 2012, s. 20-23, University of Guanajuato, Guanajuato, Mexico.
- IES La Magdalena. Aviles. Asturien. (s.f.). Allotropiske former for kulstof. [PDF]. Gendannet fra: fisquiweb.es
- Wikipedia. (2019). Carbon allotropes. Gendannet fra: es.wikipedia.org
- Sederberg David. (s.f.). Allotropes af kulstof. Gendannet fra: web.ics.purdue.edu
- Sederberg, D. (2009). Allotropes af kulstof: Det er på den måde, du er sammensat. Gendannet fra: physics.purdue.edu
- Hirsh A. (2010). Epoken med kulstofallotroper. Institut for Kemi og Farmaci & Interdisciplinært Center for Molekylære Materialer (ICMM), Friedrich-Alexander Universitet Erlangen-Nürnberg, Henkestrasse 42, 91054 Erlangen, Tyskland.
- Bestyrelsen for regenter ved University of Wisconsin System. (2013). Nanorør og andre former for kulstof. Gendannet fra: chemistry.beloit.edu
- Clark Jim. (2012). Kæmpe kovalente strukturer. Gendannet fra: chemguide.co.uk



Endnu ingen kommentarer