
Anisoles struktur, egenskaber, nomenklatur, risici og anvendelser
Det anisol eller methoxybenzen er en organisk forbindelse bestående af en aromatisk ether, hvis kemiske formel er C6H5OCH3. Dens fysiske tilstand er den af en farveløs væske, der kan give gule farver. Det genkendes let ved sin karakteristiske anisluft.
Det er så en flygtig forbindelse og ikke meget høje samhørighedskræfter; typiske egenskaber ved lette ethere, der opbevares i små forseglede beholdere. Specifikt er anisol den enkleste af alkylaryletherne; det vil sige dem med en aromatisk komponent (Ar) og en anden alkylkomponent (R), Ar-O-R.
Gruppe C6H5- kommer til at betegne Ar og -CH3 til R og har således C6H5-O-CH3. Den aromatiske ring og tilstedeværelsen af -OCH3 Som en substituentgruppe kaldet methoxy giver det anisol en nukleofilicitet, der er bedre end benzen og nitrobenzen. Derfor tjener det som et mellemliggende molekyle til syntese af forbindelser med farmakologisk aktivitet..
Dens karakteristiske anisluft er blevet brugt til at tilføje anisol til kosmetiske og hygiejneprodukter, der kræver en behagelig duft..
Artikelindeks
- 1 Struktur af anisol
- 1.1 Dipolmoment
- 1.2 Krystaller
- 2 egenskaber
- 2.1 Fysisk udseende
- 2.2 Lugt
- 2.3 Smag
- 2.4 Molekylær masse
- 2,5 Massefylde
- 2.6 Dampmassefylde
- 2.7 Smeltepunkt
- 2.8 Kogepunkt
- 2.9 Flammepunkt
- 2.10 Selvantændelsestemperatur
- 2.11 Viskositet
- 2.12 Overfladespænding
- 2.13 Brydningsindeks
- 2.14 Opløselighed
- 2.15 nukleofilicitet
- 2.16 Reaktivitet
- 3 Nomenklatur
- 4 risici
- 5 anvendelser
- 5.1 Organiske synteser
- 5.2 Dufte
- 6 Referencer
Anisoles struktur
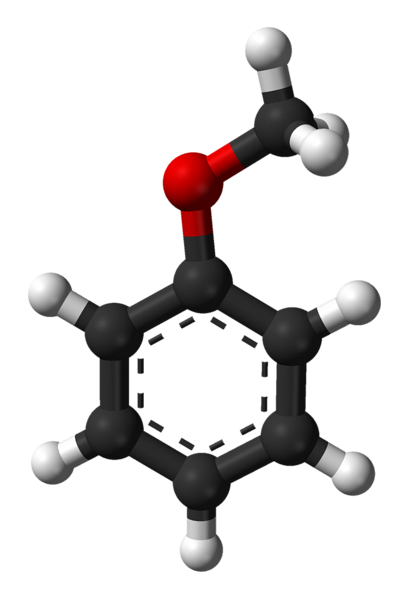
Det øverste billede viser den molekylære struktur af anisol ved hjælp af en kugle- og søjlemodel. Den aromatiske ring værdsættes, hvis kulstoffer er spto og derfor er det fladt, som et sekskantet ark; og knyttet til den er methoxygruppen, hvis carbon er sp3, og dets hydrogener er over eller under ringplanet.
Vigtigheden af -OCH-gruppen3 i strukturen går det ud over at bryde med molekylets plane geometri: det giver polaritet på det, og følgelig får det apolare molekyle af benzen et permanent dipolmoment.
Dipole øjeblik
Dette dipolmoment skyldes iltatomet, som tiltrækker elektrondensiteterne i både de aromatiske og methylringe. Takket være dette kan anisolmolekyler interagere gennem dipol-dipolkræfter; Selvom det mangler enhver mulighed for at danne hydrogenbindinger, da det er en ether (ROR har ikke H forbundet med ilt).
Dens høje kogepunkt (154 ° C) certificerer eksperimentelt de stærke intermolekylære interaktioner, der styrer dets væske. Ligeledes er London-spredningskræfterne til stede afhængigt af molekylmassen og π-π-interaktionerne mellem selve ringene.
Krystaller
Anisolens struktur tillader imidlertid ikke, at den interagerer stærkt nok til at optage et fast stof ved stuetemperatur (smp. = -37 ° C). Dette kan også skyldes det faktum, at når de intermolekylære afstande reduceres, begynder de elektrostatiske frastødninger mellem elektronerne i tilstødende aromatiske ringe at få meget kraft..
Derfor og ifølge krystallografiske undersøgelser kan anisolmolekylerne i krystaller ved en temperatur på -173 ° C ikke arrangeres på en sådan måde, at deres ringe vender mod hinanden; det vil sige, at deres aromatiske centre ikke er opstillet oven på hinanden, men snarere en gruppe -OCH3 er over eller under en tilstødende ring.
Ejendomme
Fysisk fremtoning
Farveløs væske, men der kan have små stråfarvede toner.
Lugt
Lugter lidt lig anisfrø.
Smag
Slik; det er dog moderat giftigt, så denne test er farlig.
Molekylær masse
108,140 g / mol.
Massefylde
0,995 g / ml.
Dampmassefylde
3,72 (i forhold til luft = 1).
Smeltepunkt
-37 ° C.
Kogepunkt
154 ° C.
antændelsespunkt
125ºC (åben kop).
Selvantændelsestemperatur
475ºC.
Viskositet
0,778 cP ved 30 ° C.
Overfladespænding
34,15 dynes / cm ved 30 ° C.
Brydningsindikator
1.5179 ved 20 ° C.
Opløselighed
Dårligt opløseligt i vand (ca. 1 mg / ml). I andre opløsningsmidler, såsom acetone, ethere og alkoholer, er det imidlertid meget opløseligt.
Nukleofilicitet
Den aromatiske ring af anisol er rig på elektroner. Dette skyldes, at ilt til trods for at være et stærkt elektronegativt atom, bidrager med elektronerne fra dets π-sky til at aflokalisere dem gennem ringen i adskillige resonansstrukturer. Derfor rejser flere elektroner gennem det aromatiske system, og dets nukleofilicitet øges derfor..
Forøgelsen i nukleofilicitet er eksperimentelt demonstreret ved at sammenligne dens reaktivitet mod aromatiske elektrofile substitutioner med benzen. Således fremgår den bemærkelsesværdige virkning af -OCH-gruppen.3 på forbindelsens kemiske egenskaber.
Det skal ligeledes bemærkes, at de elektrofile substitutioner forekommer i positionerne ved siden af (-orto) og modsat (-par) til methoxygruppen; det vil sige, det er ortho-para direktør.
Reaktivitet
Nukleofiliciteten i den aromatiske anisolering tillader allerede et glimt af dens reaktivitet. Substitutionerne kan forekomme enten i ringen (begunstiget af dens nukleofilicitet) eller i selve methoxygruppen; i sidstnævnte er O-CH-bindingen brudt3 at udskifte -CH3 ved en anden alkylgruppe: O-alkylering.
I en alkyleringsproces kan anisolen derfor acceptere en R-gruppe (fragment af et andet molekyle) ved at substituere et H på dets ring (C-alkylering) eller ved at substituere CH3 af dets methoxy-gruppe. Følgende billede illustrerer, hvad der lige er blevet sagt:
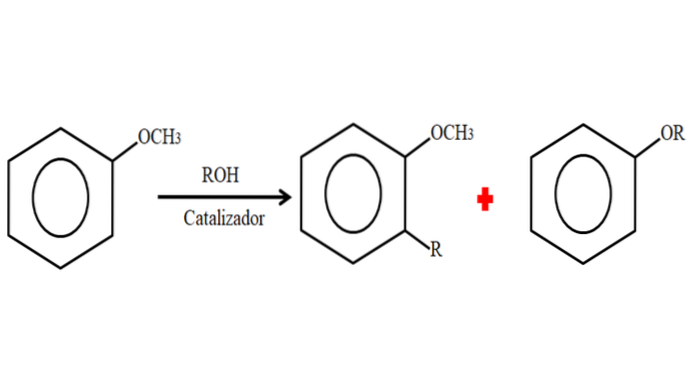
På billedet er R-gruppen placeret i -orto-positionen, men den kan også være i -paraposition, modsat -OCH3. Når O-alkylering sker, opnås en ny ether med en anden -OR-gruppe.
Nomenklatur
Navnet 'anisole' er det mest kendte og mest accepterede, sandsynligvis afledt af dens anislignende lugt. Navnet 'methoxybenzen' er dog ret specifikt, da det med det samme fastslår, hvad denne aromatiske ether er strukturen og identiteten; dette er navnet styret af den systematiske nomenklatur.
Et andet mindre brugt, men lige så gyldigt navn er 'phenylmethylether', som er underlagt den traditionelle nomenklatur. Dette er måske det mest specifikke navn af alle, da det direkte angiver, hvilke er de to strukturelle dele af etheren: phenyl-O-methyl, C6H5-O-CH3.
Risici
Medicinske studier har endnu ikke været i stand til at demonstrere de mulige dødelige virkninger af anisol i kroppen ved lave doser. Men som næsten alle kemikalier forårsager det irritation, når det udsættes for længe og i moderate koncentrationer til hud, hals, lunger og øjne..
På grund af ringens nukleofilicitet metaboliseres også en del af den og er derfor biologisk nedbrydeligt. Faktisk viste simuleringer, som et resultat af denne egenskab, at den ikke kan koncentrere sig i vandige økosystemer, da dets organismer først nedbrydes; og derfor kan floder, søer eller have ophobes anisole.
I jord fordampes den hurtigt på grund af dens flygtighed og transporteres væk af luftstrømme; Når det er tilfældet, påvirker det heller ikke de vegetabilske masser eller plantager i væsentlig grad.
På den anden side reagerer det atmosfærisk med frie radikaler og udgør derfor ikke en risiko for forurening for den luft, vi indånder..
Ansøgninger
Organiske synteser
Fra anisol kan andre derivater opnås ved aromatisk elektrofil substitution. Dette gør det muligt for det at blive brugt som et mellemprodukt til syntesen af lægemidler, pesticider og opløsningsmidler, hvortil det ønskes at tilføje dets egenskaber. Syntetiske ruter kan hovedsagelig bestå af C-alkylering eller O-alkylering.
Dufte
Ud over dets anvendelse til organisk syntese kan det bruges direkte som et additiv til cremer, salver og parfume, der inkorporerer anis-dufte til sådanne produkter..
Referencer
- Morrison, R. T. og Boyd, R, N. (1987). Organisk kemi. 5. udgave. Redaktionel Addison-Wesley Interamericana.
- Carey F.A. (2008). Organisk kemi. (Sjette udgave). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10. udgave.). Wiley plus.
- National Center for Biotechnology Information. (2019). Anisole. PubChem-database, CID = 7519. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Anisole. Gendannet fra: en.wikipedia.org
- Pereira, Cynthia C. M., de la Cruz, Marcus H. C., & Lachter, Elizabeth R. (2010). Flydende fase-alkylering af anisol og phenol katalyseret af niobiumphosphat. Journal of the Brazilian Chemical Society, 21 (2), 367-370. dx.doi.org/10.1590/S0103-50532010000200025
- Seidel R. W. og Goddard R. (2015). Anisole ved 100 K: den første bestemmelse af krystalstruktur. Acta Crystallogr C Struct Chem. Aug. 71 (Pt 8): 664-6. doi: 10.1107 / S2053229615012553
- Kemisk formulering. (2018). Methoxybenzen Gendannet fra: formulacionquimica.com


Endnu ingen kommentarer