
Karakteristiske baser og eksempler

Det baser de er alle de kemiske forbindelser, der kan acceptere protoner eller donere elektroner. I naturen eller kunstigt er der både uorganiske og organiske baser. Derfor kan dets adfærd forudsiges for mange ioniske molekyler eller faste stoffer..
Det, der adskiller en base fra resten af de kemiske stoffer, er imidlertid dens markante tendens til at donere elektroner sammenlignet med for eksempel arter med ringe elektrontæthed. Dette er kun muligt, hvis det elektroniske par er placeret. Som en konsekvens af dette har baser elektronrige regioner, δ-.

Hvilke organoleptiske egenskaber gør det muligt at identificere baserne? De er generelt ætsende stoffer, som forårsager alvorlige forbrændinger ved fysisk kontakt. På samme tid har de en sæbevisting, og de opløser let fedt. Derudover er dens smag bitter.
Hvor er de i det daglige liv? En kommerciel og rutinemæssig kilde til fonde er rengøringsprodukter, fra vaskemidler til håndsæber. Af denne grund kan billedet af bobler ophængt i luften hjælpe med at huske baserne, selvom der bagved er mange fysisk-kemiske fænomener involveret..
Mange baser udviser helt forskellige egenskaber. For eksempel har nogle dårlige og stærke lugte, såsom organiske aminer. Andre på den anden side, såsom ammoniak, er gennemtrængende og irriterende. De kan også være farveløse væsker eller ioniske hvide faste stoffer..
Imidlertid har alle baser en ting til fælles: de reagerer med syrer og producerer opløselige salte i polære opløsningsmidler, såsom vand..
Artikelindeks
- 1 Karakteristik af baserne
- 1.1 Fysiske egenskaber
- 1.2 Styrken af en base
- 1,3 pH større end 7
- 1.4 Evne til at neutralisere syrer
- 1.5 Oxidereduktionskapacitet
- 1.6 Slip OH-
- 1.7 De har nitrogenatomer eller substituenter, der tiltrækker elektrondensitet
- 2 Eksempler på baser
- 2.1 NaOH
- 2.2 CH3OCH3
- 2.3 Alkalihydroxider
- 2.4 Organiske baser
- 2,5 NaHCO3
- 3 Referencer
Basernes egenskaber

Bortset fra hvad der allerede er nævnt, hvilke specifikke egenskaber skal alle baser have? Hvordan kan de acceptere protoner eller donere elektroner? Svaret ligger i elektronegativiteten af molekylets eller ionens atomer; og blandt dem alle er ilt den dominerende, især når det findes som en hydroxylion, OH-.
Fysiske egenskaber
Baserne har en sur smag og er med undtagelse af ammoniak lugtfri. Dens struktur er glat og har evnen til at ændre farven på lakmuspapir til blå, methylorange til gul og phenolphthalein til lilla..
Styrken af en base
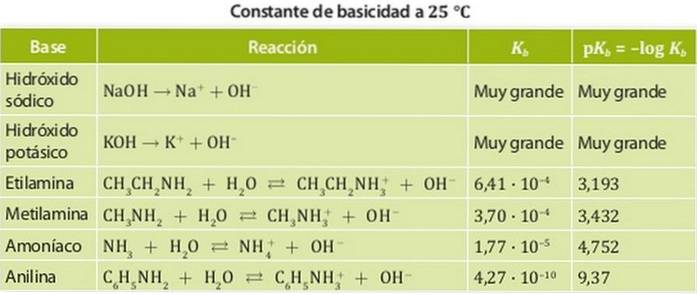
Baser klassificeres i stærke baser og svage baser. Styrken af en base er forbundet med dens ligevægtskonstant, derfor kaldes disse konstanter i tilfælde af baser basiskonstanter Kb.
Således har stærke baser en stor grundlæggende konstant, så de har tendens til at adskille sig fuldstændigt. Eksempler på disse syrer er alkalier, såsom natrium- eller kaliumhydroxid, hvis basiskonstanter er så store, at de ikke kan måles i vand..
På den anden side er en svag base en, hvis dissociationskonstant er lav, så den er i kemisk ligevægt.
Eksempler på disse er ammoniak og aminer, hvis surhedskonstanter er i størrelsesordenen 10-4. Figur 1 viser de forskellige surhedskonstanter for forskellige baser.
pH større end 7
PH-skalaen måler en opløsnings alkalinitet eller surhedsgrad. Skalaen varierer fra nul til 14. En pH mindre end 7 er sur. En pH større end 7 er basisk. Midtpunkt 7 repræsenterer en neutral pH. En neutral opløsning er hverken sur eller basisk.
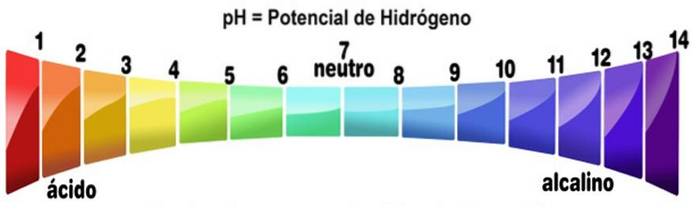
PH-skalaen opnås som en funktion af koncentrationen af H+ i løsningen og er omvendt proportional med den. Baser øger pH-værdien ved en opløsning ved at reducere koncentrationen af protoner.
Evne til at neutralisere syrer
Arrhenius foreslår i sin teori, at syrer ved at være i stand til at danne protoner reagerer med hydroxylen af baserne for at danne salt og vand på følgende måde:
HCI + NaOH → NaCl + HtoELLER.
Denne reaktion kaldes neutralisering og er grundlaget for den analytiske teknik kaldet titrering..
Oxidereduktionskapacitet
På grund af deres evne til at producere ladede arter bruges baser som et medium til elektronoverførsel i redoxreaktioner..
Baser har også en tendens til at oxidere, da de har evnen til at donere gratis elektroner..
Baserne indeholder OH-ioner. De kan handle for at donere elektroner. Aluminium er et metal, der reagerer med baser.
2Al + 2NaOH + 6HtoO → 2NaAl (OH)4+3Hto
De korroderer ikke mange metaller, fordi metaller har tendens til at miste snarere end at acceptere elektroner, men baser er stærkt ætsende for organiske stoffer som dem, der udgør cellemembranen..
Disse reaktioner er normalt eksoterme, hvilket medfører alvorlige forbrændinger ved kontakt med huden, så denne type stof skal håndteres med forsigtighed. Figur 3 er sikkerhedsindikatoren, når et stof er ætsende.

De frigiver OH-
Til at begynde med OH- Det kan være til stede i mange forbindelser, hovedsageligt i metalhydroxider, da det i selskab med metaller har tendens til at "snappe" protoner til dannelse af vand. Således kan en base være ethvert stof, der frigiver denne ion i opløsning gennem en opløselighedsligevægt:
M (OH)to <=> Mto+ + 2OH-
Hvis hydroxidet er meget opløseligt, forskydes ligevægten helt til højre for den kemiske ligning, og vi taler om en stærk base. M (OH)to , i stedet er det en svag base, da den ikke helt frigiver sine OH-ioner- i vand. En gang OH- produceret kan neutralisere enhver syre der er omkring den:
Åh- + HA => A- + HtoELLER
Og så OH- deprotonates syre HA til at transformere til vand. Hvorfor? Fordi iltatomet er meget elektronegativt og også har en overskydende elektrondensitet på grund af den negative ladning.
O har tre par frie elektroner og kan donere en hvilken som helst af dem til det delvist positivt ladede H-atom, δ +. Ligeledes favoriserer den store energistabilitet i vandmolekylet reaktionen. Med andre ord: HtoEller det er meget mere stabilt end HA, og når dette er sandt, vil neutraliseringsreaktionen forekomme.
Konjugerede baser
Og hvad med OH- allerede-? Begge er baser med den forskel, at A- er konjugeret base syre HA. Desuden A- er en meget svagere base end OH-. Herfra nåes følgende konklusion: en base reagerer for at generere en svagere.
Grundlag Stærk + Syre Stærk => Base Svag + Syre Svag
Som det kan ses af den generelle kemiske ligning, gælder det samme for syrer.
Konjugatbase A- kan deprotonere et molekyle i en reaktion kendt som hydrolyse:
TIL- + HtoELLER <=> HA + OH-
Men i modsætning til OH-, det skaber en ligevægt, når det neutraliseres med vand. Igen er det fordi A- det er en meget svagere base, men nok til at fremkalde en ændring i opløsningens pH.
Derfor er alle de salte, der indeholder A- de er kendt som basiske salte. Et eksempel på disse er natriumcarbonat, NatoCO3, som efter opløsning basiserer opløsningen gennem hydrolysereaktionen:
CO3to- + HtoELLER <=> HCO3- + Åh-
De har nitrogenatomer eller substituenter, der tiltrækker elektrondensitet
En base er ikke kun ioniske faste stoffer med OH-anioner- i deres krystalgitter kan de også have andre elektronegative atomer som kvælstof. Disse typer baser hører til organisk kemi, og blandt de mest almindelige er aminer.
Hvad er amingruppen? R-NHto. På nitrogenatomet er der et ikke-delt elektronisk par, som kan såvel som OH-, deprotonere et vandmolekyle:
R-NHto + HtoELLER <=> RNH3+ + Åh-
Ligevægten er meget forskudt til venstre, da amin, selvom den er basisk, er meget svagere end OH-. Bemærk, at reaktionen svarer til den, der er givet for ammoniakmolekylet:
NH3 + HtoELLER <=> NH4+ + Åh-
Kun aminer kan ikke danne kationen korrekt, NH4+; skønt RNH3+ er ammoniumkationen med en monosubstitution.
Og kan det reagere med andre forbindelser? Ja, med alle, der har tilstrækkeligt surt brint, selvom reaktionen ikke sker fuldstændigt. Det vil sige, at kun en meget stærk amin reagerer uden at skabe ligevægt. Ligeledes kan aminer donere deres elektronpar til andre arter end H (såsom alkylradikaler: -CH3).
Baser med aromatiske ringe
Aminer kan også have aromatiske ringe. Hvis dets par af elektroner kan "gå tabt" inde i ringen, fordi ringen tiltrækker elektrondensitet, vil dens basalitet falde. Hvorfor? Fordi jo mere lokaliseret nævnte par er inden for strukturen, jo hurtigere vil det reagere med de elektronfattige arter.
For eksempel NH3 det er grundlæggende, fordi dets elektronpar ikke har nogen steder at gå. Det samme sker med aminer, uanset om de er primære (RNHto), sekundær (RtoNH) eller tertiær (R3N). Disse er mere basiske end ammoniak, fordi ud over det, der netop er blevet forklaret, tiltrækker nitrogen højere elektroniske densiteter af R-substituenterne og øger således δ-.
Men når der er en aromatisk ring, kan parret indgå i resonans indeni det, hvilket gør det umuligt at deltage i dannelsen af bindinger med H eller andre arter. Derfor har aromatiske aminer en tendens til at være mindre basiske, medmindre elektronparet forbliver fikseret på nitrogen (som med pyridinmolekylet).
Eksempler på baser
NaOH
Natriumhydroxid er en af de mest anvendte baser over hele verden. Dets anvendelser er utallige, men blandt dem kan vi nævne dets anvendelse til forsæbning af nogle fedtstoffer og således fremstille basiske salte af fedtsyrer (sæber).
CH3OCH3
Strukturelt kan det synes, at acetone ikke accepterer protoner (eller donerer elektroner), men det gør det, selvom det er en meget svag base. Dette skyldes, at det elektronegative O-atom tiltrækker CH-gruppernes elektronskyer.3, fremhæver tilstedeværelsen af dets to par elektroner (: O :).
Alkali-hydroxider
Bortset fra NaOH er alkalimetalhydroxider også stærke baser (med den lille undtagelse af LiOH). Således er der blandt andre baser følgende:
-KOH: kaliumhydroxid eller kaustisk kaliumchlorid, det er en af de mest anvendte baser i laboratoriet eller i industrien på grund af dets store affedtningskraft.
-RbOH: rubidiumhydroxid.
-CsOH: cæsiumhydroxid.
-FrOH: franciumhydroxid, hvis grundlæggende teori antages at være en af de stærkeste nogensinde kendt.
Organiske baser
-CH3CHtoNHto: ethylamin.
-LiNHto: lithiumamid. Sammen med natriumamid, NaNHto, de er en af de stærkeste organiske baser. I dem er amidanionen, NHto- det er basen, der deprotonerer vand eller reagerer med syrer.
-CH3ONa: natriummethoxid. Her er basen anionen CH3ELLER-, som kan reagere med syrer til dannelse af methanol, CH3Åh.
-Grignard-reagenser: har et metalatom og et halogen, RMX. I dette tilfælde er radikalen R basen, men ikke netop fordi den fjerner et surt brint, men fordi det opgiver sit par elektroner, som det deler med metalatomet. For eksempel: ethylmagnesiumbromid, CH3CHtoMgBr. De er meget nyttige i organisk syntese.
NaHCO3
Bagepulver bruges til at neutralisere surhedsgrad under milde forhold, for eksempel inde i munden som et additiv i tandpastaer.
Referencer
- Merck KGaA. (2018). Organiske baser. Hentet fra: sigmaaldrich.com
- Wikipedia. (2018). Baser (kemi). Hentet fra: es.wikipedia.org
- Kemi 1010. Syrer og baser: Hvad de er, og hvor de findes. [PDF]. Hentet fra: cactus.dixie.edu
- Syrer, baser og pH-skalaen. Hentet fra: 2.nau.edu
- Bodner-gruppen. Definitioner af syrer og baser og vandets rolle. Hentet fra: chemed.chem.purdue.edu
- Kemi LibreTexts. Baser: Egenskaber og eksempler. Hentet fra: chem.libretexts.org
- Shiver & Atkins. (2008). Uorganisk kemi. På Syrer og baser. (fjerde udgave). Mc Graw Hill.
- Helmenstine, Todd. (4. august 2018). Navne på 10 baser. Gendannet fra: thoughtco.com


Endnu ingen kommentarer