
Bromhistorie, struktur, elektronkonfiguration, egenskaber, anvendelser
Det brom Det er et ikke-metallisk element, der hører til gruppen af halogener, gruppe 17 (VIIA) i det periodiske system. Dens kemiske symbol er Br. Det fremstår som et diatomisk molekyle, hvis atomer er bundet af en kovalent binding, hvortil det er tildelt molekylformlen Brto.
I modsætning til fluor og klor er brom under jordbund ikke en gas, men en rødbrun væske (billedet nedenfor). Det ryger, og det er sammen med kviksølv de eneste flydende elementer. Under det kan jod, selvom det intensiverer sin farve og bliver lilla, krystallisere til et flygtigt fast stof.

Brom blev opdaget uafhængigt i 1825 af Carl Löwig, der studerede under ledelse af den tyske kemiker Leopold Gmelin; og i 1826 af den franske kemiker Antoine-Jérome Balard. Men offentliggørelsen af Balards eksperimentelle resultater forud for Löwigs..
Brom er det 62. mest forekommende element på Jorden, der fordeles i lave koncentrationer gennem jordskorpen. I havet er den gennemsnitlige koncentration 65 ppm. Den menneskelige krop indeholder 0,0004% brom, og dens funktion er ikke endeligt kendt..
Dette element udnyttes kommercielt i saltlage eller steder, der på grund af særlige forhold er steder med høj koncentration af salte; for eksempel Det Døde Hav, hvortil vandet i de omkringliggende territorier flyder sammen, mættet med salte.
Det er et ætsende element, der er i stand til at angribe metaller, såsom platin og palladium. Opløst i vand kan brom også udøve sin ætsende virkning på humant væv, hvilket forværrer situationen, fordi der kan dannes brombrintesyre. Med hensyn til dets toksicitet kan det forårsage betydelig skade på organer, såsom lever, nyrer, lunger og mave.
Brom er meget skadeligt i atmosfæren og er 40-100 gange mere destruktivt for ozonlaget end klor. Halvdelen af tabet af ozonlaget i Antarktis frembringes ved reaktioner relateret til brommethyl, en forbindelse, der anvendes som fumigant.
Det har adskillige anvendelser, såsom: brandhæmmende middel, blegemiddel, overfladedesinfektionsmiddel, brændstofadditiv, mellemprodukt til fremstilling af beroligende middel, til fremstilling af organiske kemikalier osv..
Artikelindeks
- 1 Historie
- 1.1 Carl Löwigs arbejde
- 1.2 Antoine Balards arbejde
- 2 Struktur og elektronkonfiguration af brom
- 2.1 Molekyle
- 2.2 Krystaller
- 2.3 Valenslag og oxidationstilstande
- 3 egenskaber
- 3.1 Fysisk udseende
- 3.2 Atomvægt
- 3,3 atomnummer
- 3.4 Lugt
- 3.5 Smeltepunkt
- 3.6 Kogepunkt
- 3.7 Densitet (Br2) væske
- 3.8 Opløselighed i vand
- 3.9 Opløseligheder
- 3.10 tredobbelt punkt
- 3.11 Kritisk punkt
- 3.12 Fusionsvarme (Br2)
- 3.13 Fordampningsvarme (Br2)
- 3.14 Molær varmekapacitet (Br2)
- 3.15 Damptryk
- 3.16 Selvantændelsestemperatur
- 3.17 Flammepunkt
- 3.18 Opbevaringstemperatur
- 3.19 Overfladespænding
- 3.20 Lugttærskel
- 3.21 Brydningsindeks (ηD)
- 3.22 Elektronegativitet
- 3.23 Ioniseringsenergi
- 3.24 Atomeradius
- 3.25 Kovalent radius
- 3.26 Van der Waals radius
- 3.27 Reaktivitet
- 4 anvendelser
- 4.1 Benzintilsætningsstof
- 4.2 Pesticider
- 4.3 Kontrol af kviksølvemission
- 4.4 Fotografering
- 4.5 Terapeutiske handlinger
- 4.6 Brandhæmmende
- 4.7 Fødevaretilsætningsstof
- 4.8 Reagenser og kemisk mellemprodukt
- 4.9 Biologisk virkning
- 5 Hvor kan man finde det?
- 6 risici
- 7 Referencer
Historie
Carl Löwigs arbejde
Brom blev opdaget uafhængigt og næsten samtidigt af Carl Jacob Löwig, en tysk kemiker i 1825, og af Antoine Balard, en fransk kemiker i 1826..
Carl Löwig, en discipel af den tyske kemiker Leopold Gmelin, samlede vand fra en kilde i Bad Kreuznach og tilsatte klor til den; efter tilsætningen af etheren blev den flydende blanding omrørt.
Derefter blev etheren destilleret af og koncentreret ved inddampning. Som et resultat opnåede han et rødbrunt stof, som var brom.
Antoine Balards arbejde
Balard på sin side brugte aske fra en brunalge kendt som fucus og blandede dem med saltlage, ekstraheret fra Montpellier-saltfladerne. Således frigav han brom og fik klor til at passere gennem det vandige materiale, der blev udsat for ekstraktion, hvor magnesiumbromidet, MgBr, var til stede.to.
Derefter blev materialet destilleret i nærværelse af mangandioxid og svovlsyre, hvilket frembragte røde dampe, der kondenserede til en mørk væske. Balard troede, det var et nyt element og kaldte det muride, afledt af det latinske ord muria, som saltlage blev betegnet med.
Det er blevet bemærket, at Balard ændrede navnet fra muride til brôme efter forslag fra Anglada eller Gay-Lussac, baseret på det faktum, at brôme betyder foul, som definerer lugten af det opdagede element..
Resultaterne blev offentliggjort af Belard i Annales of Chemie and Physique, inden Löwig offentliggjorde hans.
Først fra 1858 var det muligt at producere brom i betydelige mængder; år blev saltforekomsterne i Stassfurt opdaget og udnyttet, hvilket gav brom som et biprodukt af kaliumchlorid.
Struktur og elektronkonfiguration af brom
Molekyle

Det øverste billede viser brommolekylet, Brto, med en kompakt påfyldningsmodel. Faktisk er der en simpel kovalent binding mellem de to bromatomer, Br-Br.
Da det er et homogent og diatomisk molekyle, mangler det et permanent dipolmoment og kan kun interagere med andre af samme type ved hjælp af Londons spredningskræfter..
Dette er grunden til, at dens rødlige væske ryger; i Br-molekylerto, skønt de er relativt tunge, holder deres intermolekylære kræfter dem løst sammen.
Brom er mindre elektronegativ end klor og har derfor en mindre attraktiv virkning på elektronerne i valensskallene. Som et resultat kræver det mindre energi at rejse højere energiniveauer, absorbere grønne fotoner og reflektere en rødlig farve..
Krystaller
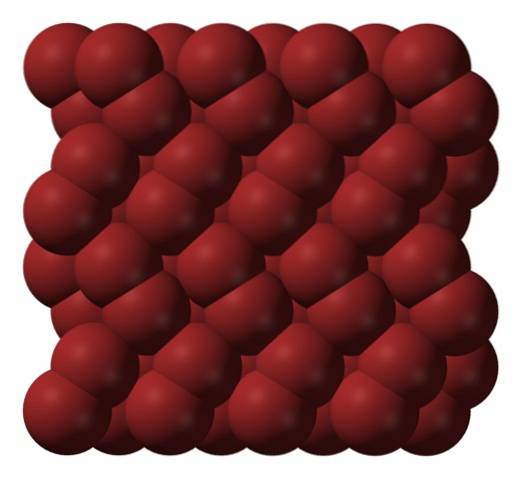
I gasfasen er Br-molekylerneto de adskiller sig betydeligt, indtil der ikke er nogen effektive interaktioner mellem dem. Under dets smeltepunkt kan brom dog fryse i rødlige orthorhombiske krystaller (øverste billede).
Bemærk hvordan Br-molekylerneto de er ordnet pænt på en sådan måde, at de ligner "bromorme". Her og ved disse temperaturer (T < -7,2°C), las fuerzas de dispersión son suficientes para que las vibraciones de las moléculas no desmoronen el cristal en el acto; pero aún así, varias de ellas sublimarán constantemente.
Valenslag og oxidationstilstande
Elektronkonfigurationen af brom er:
[Ar] 3d104sto 4p5
At være 3d104sto 4p5 dens valensskal (selvom den 3d orbital10 spiller ikke en førende rolle i deres kemiske reaktioner). Elektronerne i 4s og 4p orbitalerne er de yderste og tilføjer op til i alt 7, kun en elektron fra at fuldføre valensoktet.
Fra denne konfiguration kan de mulige oxidationstilstande for brom udledes: -1, hvis den får en elektron til at være isoelektronisk over for krypton; +1, forbliver som 3d104sto 4p4; +3, +4 og +5, mister alle elektroner fra 4p-orbitalen ([Ar] 3d104sto4p0); og +7, og efterlader ingen elektroner i 4s orbitalen ([Ar] 3d104s04p0).
Ejendomme
Fysisk fremtoning
Mørk rødbrun rygende væske. Det findes i naturen som et diatomisk molekyle med atomerne forbundet med en kovalent binding. Brom er væske tættere end vand og synker ned i det.
Atomvægt
79,904 g / mol.
Atom nummer
35.
Lugt
En skarp, kvælende og irriterende røg.
Smeltepunkt
-7,2 ºC.
Kogepunkt
58,8 ºC.
Densitet (Brto) væske
3,1028 g / cm3
Vandopløselighed
33,6 g / L ved 25 ° C Opløseligheden af brom i vand er lav og har tendens til at stige med faldende temperatur; adfærd svarende til andre gasser.
Opløseligheder
Frit opløseligt i alkohol, ether, chloroform, carbontetrachlorid, carbondisulfid og koncentreret saltsyre. Opløselig i ikke-polære og nogle polære opløsningsmidler, såsom alkohol, svovlsyre og mange halogenerede opløsningsmidler.
Triple point
265,9 K til 5,8 kPa.
Kritisk punkt
588 K ved 10,34 MPa.
Fusionsvarme (Brto)
10.571 kJ / mol.
Fordampningsvarme (Brto)
29,96 kJ / mol.
Molær varmekapacitet (Brto)
75,69 kJ / mol.
Damptryk
Ved en temperatur på 270 K, 10 kPa.
Selvantændelsestemperatur
Ikke brandfarligt.
antændelsespunkt
113 ºC.
Stuetemperatur
2 til 8 ºC.
Overfladespænding
40,9 mN / m ved 25 ºC.
Lugtgrænse
0,05-3,5 ppm. 0,39 mg / m3
Brydningsindeks (ηD)
1,6083 ved 20 ° C og 1,6478 ved 25 ° C.
Elektronegativitet
2.96 på Pauling-skalaen.
Ioniseringsenergi
- Første niveau: 1.139,9 kJ / mol.
- Andet niveau: 2.103 kJ / mol.
- Tredje niveau: 3.470 kJ / mol.
Atomic radio
120.00.
Kovalent radius
120.3.
Van der Waals radio
Kl. 185.
Reaktivitet
Det er mindre reaktivt end klor, men mere reaktivt end jod. Det er en oxidant, der er mindre stærk end klor og stærkere end jod. Det er også et svagere reduktionsmiddel end jod, men stærkere end klor..
Klordamp er meget ætsende for mange materialer og humane væv. Angriber mange metalelementer, herunder platin og palladium; men det angriber ikke bly, nikkel, magnesium, jern, zink og under 300 ºC hverken natrium.
Brom i vand gennemgår en ændring og bliver til bromid. Det kan også eksistere som bromat (BrO3-afhængigt af væskens pH.
På grund af dets oxiderende virkning kan brom inducere frigivelse af iltfrie radikaler. Disse er stærke oxidanter og kan forårsage vævsskader. Brom kan også spontant antænde, når det kombineres med kalium, fosfor eller tin..
Ansøgninger
Benzintilsætningsstof
Ethylendibromid blev brugt til at fjerne potentielle blyaflejringer fra bilmotorer. Efter forbrændingen af benzin, som brugte bly som tilsætningsstof, brom kombineret med bly til dannelse af blybromid, en flygtig gas, der blev udvist gennem udstødningsrøret..
Selvom brom fjernede bly fra benzin, var dets destruktive virkning på ozonlaget meget kraftigt, hvorfor det blev kasseret til denne applikation.
Pesticider
Methylen eller bromomethylbromid blev brugt som et pesticid til at rense jord, især for at eliminere parasitiske nematoder, såsom hookworm..
Imidlertid er brugen af de fleste af de bromholdige forbindelser blevet kasseret på grund af deres destruktive virkning på ozonlaget..
Kontrol af kviksølvemission
Brom anvendes i nogle planter til at reducere emissionen af kviksølv, et meget giftigt metal..
Fotografering
Sølvbromid, ud over sølviodid og sølvchlorid, anvendes som en lysfølsom forbindelse i fotografiske emulsioner.
Terapeutiske handlinger
Kaliumbromid såvel som lithiumbromid blev brugt som almindelige beroligende midler i det 19. og tidlige 20. århundrede. Bromider i form af enkle salte anvendes stadig i nogle lande som krampestillende midler.
Imidlertid godkender den amerikanske FDA ikke brugen af brom til behandling af nogen sygdom i dag..
Brandhæmmende
Brom omdannes af flammer til hydrobromsyre, der interfererer med oxidationsreaktionen, der opstår under brand, og forårsager dens udryddelse. Bromholdige polymerer anvendes til fremstilling af brandhæmmende harpikser.
Fødevaretilsætningsstof
Spor af kaliumbromat er tilsat mel for at forbedre madlavningen.
Reagenser og kemisk mellemprodukt
Hydrogenbromid anvendes som reduktionsmiddel og katalysator til organiske reaktioner. Brom bruges som et kemisk mellemprodukt til fremstilling af medikamenter, hydrauliske væsker, kølemidler, affugtere og i hårkrøllepræparater.
Det finder også anvendelse i produktionen af brøndborevæsker, produkter til vanddesinfektion, blegemidler, overfladedesinfektionsmidler, farvestoffer, brændstofadditiver osv..
Biologisk handling
En undersøgelse udført i 2014 indikerer, at brom er en nødvendig kofaktor til biosyntese af kollagen IV, hvilket gør brom til et væsentligt element i dyrevævets udvikling. Der er dog ingen oplysninger om konsekvenserne af et underskud på elementet.
Hvor er det placeret
Brom ekstraheres kommercielt fra saltminer og dybe saltvandskummer, der findes i staten Arkansas og i Great Salt Lake i Utah, begge i USA. Denne sidste saltlage har en bromkoncentration på 0,5%.
For at ekstrahere brom tilsættes den varme gasformige klor til saltlage for at oxidere bromidionerne i opløsningen, idet den elementære brom opsamles..
Det Døde Hav, på grænsen mellem Jordan og Israel, er et lukket hav under havets overflade, hvilket gør det til en meget høj koncentration af salte.
Brom og kaliumchlorid opnås der kommercielt ved fordampning af højsaltvandet fra Det Døde Hav. I dette hav kan bromkoncentrationen nå 5 g / l.
Det findes også i høje koncentrationer i nogle varme kilder. Brominit er for eksempel et sølvbromidmineral, der findes i Bolivia og Mexico..
Risici
Brom i flydende tilstand er ætsende for humane væv. Men den største fare for mennesket kommer fra bromdampe og deres indånding..
Åndedræt i et miljø med en bromkoncentration på 11-23 mg / m3 frembringer alvorlige stød. En koncentration på 30-60 mg / m3 det er ekstremt skadeligt. I mellemtiden kan en koncentration på 200 mg være dødelig.
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- National Center for Biotechnology Information. (2019). Brom. PubChem-database. CID = 23968. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Ross Rachel. (8. februar 2017). Fakta om brom. Gendannet fra: livesscience.com
- Wikipedia. (2019). Borax. Gendannet fra: en.wikipedia.org
- Lenntech B. V. (2019). Brom. Gendannet fra: lenntech.com



Endnu ingen kommentarer