
Karakteristik af syrer og baser

Syrernes og basernes karakteristika er alle de egenskaber og kvaliteter, som vi kan skelne mellem en syre og en base med..
Ifølge Arrehnius teori, a syre er et stof, der frigiver protoner H+ når det er opløst i vand, og a grundlag er ethvert stof, der frigiver hydroxylioner OH- i vandig opløsning.
| Syrer | Baser | |
|---|---|---|
| Iondannelse | Til stede | Til stede |
| Neutraliseringsreaktion | Når du reagerer med en base. | Når det reagerer med en syre. |
| Vandopløselighed | Opløselig | Delvist opløselig. Calcium, barium og aluminiumhydroxider er dårligt opløselige. |
| Elektrisk ledningsevne | Til stede | Til stede |
| Sagen | Fast, flydende eller gasformig | Fast, flydende eller gasformig |
| Reaktion med lakmuspapir | Rød farve | Blå farve |
| PH-værdi | Under 7 | Større end 7 |
| Konjugeret modstykke | En svag syre danner en konjugatbase. | En svag base danner en konjugeret syre. |
| Ætsende virkning | Stærke syrer | Stærke baser |
Karakteristik af syrer
Syrer har flere egenskaber, som de kan identificeres med.
Evne til at danne ioner fra syrer
De vigtigste egenskaber ved sure stoffer er, at de kan ioniseres, dvs. miste eller vinde elektroner.
Saltsyre HCI, en stærk syre, ioniserer til dannelse af kloranion Cl- og proton H+.
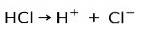
Neutraliseringsreaktion
En syre reagerer med en base for at danne et salt og vand. Denne reaktion er kendt som neutraliseringsreaktion. F.eks. Reagerer HC1 med NaOH til dannelse af natriumchlorid NaCl (køkkensalt) og vand:
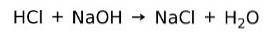
Vandopløselighed af syrer
Syrer er generelt opløselige i vand. For eksempel er saltsyre eller muriatsyre moderat opløselig i vand, op til 82 g HCI kan opløses i 100 ml vand ved 0 ° C. I tilfælde af svovlsyre HtoSW4, blanding med vand genererer varme, så det tilrådes altid at tilsætte syren til vandet for at undgå eksplosioner.
Syre styrke
Hvordan syrer dissocierer bestemmer, om de er stærke eller svage. Styrken af en syre er givet ved dens dissociationskonstant.
Salpetersyre HNO3 Det er en stærk syre fordi den i vandig opløsning ioniserer fuldstændigt til protoner og nitrationer:
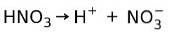
Dette betyder, at når vi tilføjer HNO3 i vand, når vi analyserer vandet, finder vi kun H+ og nitrationer og næsten ingen HNO3.
I stedet for er eddikesyren, der findes i eddike, en svag syre, fordi kun en del af det er adskilt:
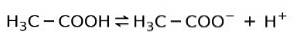
Derfor er det repræsenteret med pile i to retninger, det betyder, at vi i vandig opløsning har eddikesyre, H+ og acetatanionen (H3C-COO-).
Tilstande af syrestof
Syrer kan findes i flydende, fast eller gasformig tilstand. For eksempel er saltsyre HCI flydende, hydrogensulfid HS er en gas, og oxalsyre er et fast stof..
Reaktion med lakmuspapir fra syrer

Når vi lægger en strimmel lakmuspapir i et surt stof, bliver lakmuspapiret rødt.
Identifikation af syrer ved deres pH
PH er målingen af mængden af H.+ til stede i en løsning. Således er vi mellem pH 0 og 7 i nærværelse af en syre. For eksempel har eddike en pH-værdi lig med 2, pH-værdien af svovlsyre i bilbatterier er lig med 1.
Syrers elektriske ledningsevne
Da syrer kan dissocieres og producere elektrisk ladede ioner, kan sure opløsninger lede elektricitet. For eksempel anvendes der inden i bilbatterier svovlsyre, som er en stærk syre som leder af elektricitet..
Ætsende virkning af stærke syrer
Stærke syrer har en ætsende virkning, de kan brænde organiske væv, så deres håndtering skal være yderst forsigtig.
Svage syrer danner en konjugeret modstykke
Svage syrer, når de opløses, danner det, der er kendt som et konjugatpar, det vil sige, en svag syre danner en konjugatbase.
For eksempel:
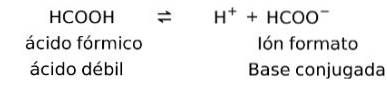
I dette tilfælde danner myresyre eller methansyre (HCOOH) det konjugerede baseionformat, når det dissocieres.
Det kan interessere dig:
- Stærke og svage syrer og baser.
- Eksempler på syrer og baser.
Basernes egenskaber
Dernæst præsenterer vi egenskaberne for baserne eller de alkaliske opløsninger, der karakteriserer dem.
Basisioniseringskapacitet
Basiske eller alkaliske stoffer er kendetegnet ved dannelse af ioner, når de opløses i vand:
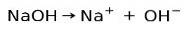
I dette tilfælde ioniserer natriumhydroxidet NaOH til dannelse af en hydroxidanion OH- og en natriumkation Na+.
En base reagerer med en syre og danner et salt
En base reagerer med en syre i en neutraliseringsreaktion til dannelse af vand og et salt, for eksempel:
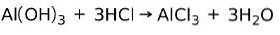
I dette tilfælde er aluminiumhydroxidet Al (OH)3, en base, reagerer med HCI og danner aluminiumchloridsaltet AlCl3 og vand. Aluminiumhydroxid bruges som et antacida til at lindre gastrisk tilbagesvaling ved at neutralisere syren produceret af maven.
Baserer vandopløselighed
Nogle baser er opløselige i vand. Jordalkaliske hydroxider, såsom calciumhydroxid og bariumhydroxid, er dårligt opløselige i vand. F.eks. Kan natriumhydroxid eller kaustisk soda opløses 109 g i 100 ml vand ved 20 ° C. Mens magnesiumhydroxid eller mælk af magnesia Mg (OH)to er praktisk talt uopløselig i vand.
Basestyrke
Afhængig af graden af ionisering af basen kan disse være stærke eller svage. For eksempel er lithiumhydroxid en stærk base fordi det i vandig opløsning ioniseres fuldstændigt til hydroxidioner OH og lithium Li-kationer+:
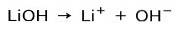
På den anden side ammoniak NH3 er en svag base for når det kommer i kontakt med vand, adskiller sig ikke al ammoniak:
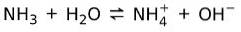
Grundlæggende tilstand af sagen
Baser kan findes i faste, flydende og gasformige tilstande. For eksempel er rent natriumhydroxid fast, ammoniak er en gas.
Reaktion med basenes lakmuspapir
Når vi lægger en strimmel lakmuspapir i et alkalisk stof, bliver papiret blåt.
Identifikation af baser ved hjælp af deres pH
Baserne er kendetegnet ved at have en pH mellem 7 og 14.
 Basernes elektriske ledningsevne
Basernes elektriske ledningsevne
Baserne på grund af deres ioniseringskapacitet er gode ledere af elektricitet. For eksempel anvendes i alkaliske batterier kaliumhydroxid KOH som en elektrisk leder..
Ætsende virkning af baser
Stærke baser kan beskadige organisk væv. For eksempel er køkkenovnsrengøringsmidler generelt stærke baser, og det anbefales altid at håndtere dem med ekstrem forsigtighed med handsker og øjenbeskyttelse..
Svage baser danner en konjugeret modstykke
De svage baser, når de opløses, danner en konjugeret modstykke, dvs. en svag base danner en konjugeret syre.
For eksempel tris- (hydroxymethyl) amino methan (OHCHto)3CNHto er en svag base, hvis konjugerede syre er (OHCHto)3CNH3+:
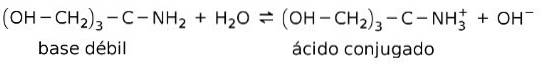
Dette er grundlaget for virkningen af bufferstoffer eller buffer, som er stoffer, der konstant bruges til at opretholde pH i opløsninger.
Du kan være interesseret i at kende forskellene mellem syrer og baser.



Endnu ingen kommentarer