
Kaliumcyanid (KCN) egenskaber, anvendelser, strukturer, risici,
Det kaliumcyanid er en uorganisk forbindelse dannet af en kalium K-ion+ og en cyanidion CN-. Dens kemiske formel er KCN. Det er et hvidt krystallinsk fast stof, ekstremt giftigt.
KCN er meget opløseligt i vand, og når det er opløst, hydrolyserer det og danner hydrocyansyre eller HCN hydrogencyanid, hvilket også er meget giftigt. Kaliumcyanid kan danne sammensatte salte med guld og sølv, hvorfor det tidligere blev brugt til at ekstrahere disse ædle metaller fra visse mineraler..

KCN bruges til at belægge billige metaller med guld og sølv gennem en elektrokemisk proces, det vil sige en metode, hvor en elektrisk strøm føres gennem en opløsning, der indeholder et salt, der består af ædle metaller, cyanid og kalium..
Kaliumcyanid, fordi det indeholder cyanid, skal håndteres med stor omhu med passende redskaber. Det skal aldrig bortskaffes i miljøet, fordi det også er meget giftigt for de fleste dyr og planter..
Imidlertid undersøges metoder, der bruger almindelige alger til at fjerne kaliumcyanid fra vand, der er forurenet med lave koncentrationer af kaliumcyanid..
Artikelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 egenskaber
- 3.1 Fysisk tilstand
- 3.2 Molekylvægt
- 3.3 Smeltepunkt
- 3.4 Kogepunkt
- 3.5 Densitet
- 3.6 Opløselighed
- 3,7 pH
- 3.8 Hydrolysekonstant
- 3.9 Kemiske egenskaber
- 3.10 Andre egenskaber
- 4 Opnåelse
- 5 Anvendelse til galvanisering af metaller
- 5.1 Sølv
- 5.2 Guld
- 5.3 Andre anvendelser
- 6 risici
- 7 Handlingsmekanisme
- 7.1 Yderligere risici
- 8 Seneste undersøgelser
- 9 Referencer
Struktur
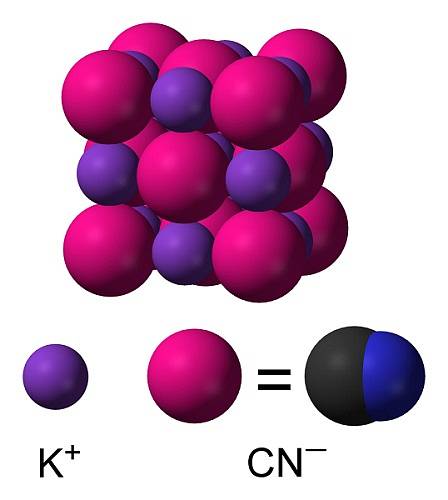
KCN er en ionisk forbindelse dannet af en kalium K-kation+ og en cyanidanion CN-. I dette er carbonatomet forbundet med nitrogenatomet ved en tredobbelt kovalent binding..

I fast kaliumcyanid er CN-anionen- Det kan rotere frit, så det opfører sig som en sfærisk anion, som følge heraf har KCN-krystallen en kubisk struktur svarende til den af kaliumchlorid KCl.
Nomenklatur
- Kaliumcyanid
- Kaliumcyanid
- Cyan-kalium
Ejendomme
Fysisk tilstand
Hvidt krystallinsk fast stof. Kubiske krystaller.
Molekylær vægt
65,116 g / mol.
Smeltepunkt
634,5 ° C
Kogepunkt
1625 ° C.
Massefylde
1,55 g / cm3 ved 20 ° C.
Opløselighed
Meget opløselig i vand: 716 g / L ved 25 ° C og 100 g / 100 ml vand ved 80 ° C. Let opløselig i methanol: 4,91 g / 100 g methanol ved 19,5 ° C. Meget let opløselig i ethanol: 0,57 g / 100 g ethanol ved 19,5 ° C.
pH
En vandig opløsning af 6,5 g KCN i 1 liter vand har en pH-værdi på 11,0.
Hydrolysekonstant
KCN er meget opløseligt i vand. Når det opløses, er cyanidionen CN fri- som tager en proton H+ vand til dannelse af hydrocyansyre HCN og frigivelse af en OH-ion-:
CN- + HtoO → HCN + OH-
Hydrolysekonstanten indikerer den tendens, hvormed reaktionen udføres.
Kh = 2,54 x 10-5
Vandige KCN-opløsninger frigiver HCN-hydrogencyanid i miljøet, når det opvarmes over 80 ° C.
Kemiske egenskaber
Det er ikke brandfarligt, men når fast KCN opvarmes til nedbrydning udsender det meget giftige gasser af hydrogencyanid HCN, nitrogenoxider NOx, kaliumoxid KtoO og kulilte CO.
KCN reagerer med guldsalte til dannelse af kaliumurocyanid KAu (CN)to og kaliumatrium KAu (CN)4. Disse er farveløse komplekse salte. Med sølvmetallet Ag danner KCN kaliumargentocyanidet KAg (CN)to.
Cyanidionen af KCN reagerer med visse organiske forbindelser, der har halogener (såsom chlor eller brom) og indtager deres plads. For eksempel reagerer det med bromeddikesyre for at give cyanoeddikesyre..
Andre egenskaber
Det er hygroskopisk, absorberer fugt fra miljøet.
Det har en mild bitter mandelluft, men det opdages ikke af alle mennesker.
Opnåelse
KCN fremstilles ved omsætning af kaliumhydroxid KOH i vandig opløsning med hydrogencyanid HCN. Det opnås også ved opvarmning af kaliumferrocyanid K4Tro (CN)6:
K4Tro (CN)6 → 4 KCN + 2 C + Nto↑ + Tro
Anvendes til galvanisering af metaller
Det bruges i processen med at belægge metaller med lav værdi med guld og sølv. Det er en elektrolytisk proces, dvs. elektricitet ledes gennem en vandig opløsning med passende salte.
Sølv
Kaliumargentocyanid KAg (CN) anvendesto til sølvbelægning (Ag) billigere metaller.
Disse placeres i en vandig opløsning af kalium argentocyanid KAg (CN)to, hvor anoden eller den positive pol er en søjle af rent sølv (Ag) og katoden eller den negative pol er det billige metal, som du vil belægge med sølv.
Når en elektrisk strøm passerer gennem opløsningen, afsættes sølvet på det andet metal. Når der anvendes cyanidsalte, afsættes sølvlaget på en finere, mere kompakt og klæbende måde end i opløsninger af andre forbindelser..

Guld
Tilsvarende i tilfælde af guld (Au), kaliumurocyanid KAu (CN)to og kaliumatrium KAu (CN)4 bruges til elektrolytisk forgyldning af andre metaller.

Andre anvendelser
Her er nogle andre anvendelser af kaliumcyanid.
- Til den industrielle proces med hærdning af stål ved nitridering (tilsætning af nitrogen).
- Til metalrensning.
- I trykning og fotograferingsprocesser.
- Tidligere blev det brugt til ekstraktion af guld og sølv fra de mineraler, der indeholder dem, men senere blev det erstattet af natriumcyanid NaCN, som er billigere, selvom det er lige så giftigt.
- Som insekticid til sprøjtning af træer, skibe, jernbanevogne og pakhuse.
- Som et reagens i analytisk kemi, det vil sige at foretage kemisk analyse.
- At fremstille andre kemiske forbindelser, såsom farvestoffer og farvestoffer.

Risici
KCN er en meget giftig forbindelse til dyr og de fleste planter og mikroorganismer. Det er klassificeret som super giftigt. Det er dødbringende selv i meget små mængder.
Dens skadelige virkning kan forekomme ved indånding, kontakt med huden eller øjnene eller ved indtagelse. Hæmmer mange metaboliske processer, især blodproteiner involveret i ilttransport, såsom hæmoglobin.
Det påvirker organer eller systemer, der er mest følsomme over for iltmangel, såsom centralnervesystemet (hjernen), det kardiovaskulære system (hjerte og blodkar) og lungerne.

Handlingsmekanisme
KCN interfererer med kroppens evne til at bruge ilt.
Cyanidionen CN- KCN har en høj affinitet for jernionen Fe3+, hvilket betyder, at når cyanid absorberes, reagerer det hurtigt med Fe3+ af blod og væv.
På denne måde forhindrer det cellerne i at trække vejret, som kommer ind i en tilstand af iltmangel, for selvom de prøver at trække vejret, kan de ikke bruge det..
Derefter er der en forbigående tilstand af hyperapnø (suspension af vejrtrækning) og hovedpine og endelig død på grund af åndedrætsstop..
Yderligere risici
Ved opvarmning producerer den meget giftige gasser såsom HCN, nitrogenoxider NOx, kaliumoxid KtoO og kulilte CO.
Når det kommer i kontakt med fugt, frigiver det HCN, som er meget brandfarligt og meget giftigt..
KCN er også meget giftig for organismer, der lever i vand. Det skal aldrig bortskaffes i miljøet, da der kan forekomme forurening af vand, hvor dyr drikker og fisk lever.
Der er dog bakterier, der producerer cyanid såsom Chromobacterium violaceum og nogle arter af Pseudomonas.
Nylige undersøgelser
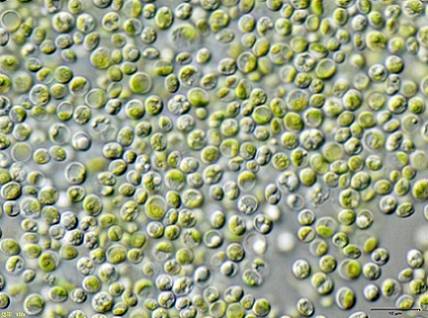
Visse forskere fandt, at grønalger Chlorella vulgaris kan bruges til at behandle vand forurenet med KCN kaliumcyanid i lave koncentrationer.
Algerne var i stand til effektivt at fjerne KCN, da dette i lave mængder stimulerede algenes vækst, da det aktiverede en intern mekanisme til at modstå KCN's toksicitet.
Dette betyder, at algen Chlorella vulgaris har potentialet til at fjerne cyanid, og at en effektiv metode til biologisk behandling af cyanidkontaminering kan designes med dette.
Referencer
- OS. National Library of Medicine. (2019). Kaliumcyanid. National Center for Biotechnology Information. Gendannet fra pubchem.ncbi.nlm.nih.gov.
- Coppock, R.W. (2009). Trusler mod vilde dyr fra kemiske krigsførere. I håndbog om toksikologi for kemiske krigsførelsesagenter. Gendannet fra sciencedirect.com.
- Liu, Q. (2017). Evaluering af fjernelse af kaliumcyanid og dets toksicitet i grønalger (Chlorella vulgaris). Bull Environ Contam Toxicol. 2018; 100 (2): 228-233. Gendannet fra ncbi.nlm.nih.gov.
- National Institute for Occupational Safety and Health (NIOSH). (2011). Kaliumcyanid: systemisk middel. Gendannet fra cdc.gov.
- Alvarado, L.J. et al. (2014). Riboswitch opdagelse, struktur og funktion. Syntese af Uracil. I Metoder i Enzymologi. Gendannet fra sciencedirect.com.

Endnu ingen kommentarer