
Cycloalkanes egenskaber, reaktioner, anvendelser, eksempler

Det cycloalkaner er en familie af mættede carbonhydrider med en generel formel af CnH2n det falder sammen med alkenernes; med den forskel, at den tilsyneladende umættethed ikke skyldes en dobbeltbinding, men en ring eller cyklus. Derfor betragtes de som isomerer af alkener.
Disse dannes, når lineære alkaner forbinder enderne af deres kæder for at skabe en lukket struktur. Som med alkaner kan cycloalkaner udvise forskellige størrelser, molekylmasser, substitutioner eller endda systemer sammensat af mere end en ring (polycyklisk).
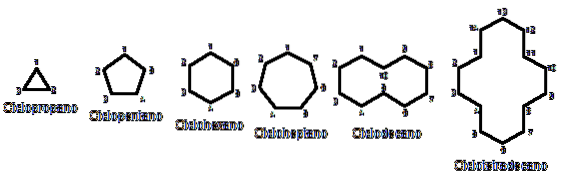
Ellers ligner de kemisk og fysisk alkaner. De har kun carbon og hydrogen, er neutrale molekyler og interagerer derfor gennem Van der Walls kræfter. De tjener også som brændstof og frigiver varme, når de brænder i nærvær af ilt..
Hvorfor er cycloalkaner mere ustabile end deres kolleger med åben kæde? Årsagen kan mistænkes ved at observere eksemplerne på cycloalkaner repræsenteret i billedet ovenfor fra et fugleperspektiv: der er steriske (rumlige) spændinger og hindringer.
Bemærk, at jo færre kulstoffer der er (anført i blåt), jo mere lukket er strukturen; og det modsatte opstår, når de øges og bliver som en halskæde.
Små cycloalkaner er gasformige, og når deres størrelser øges, øges deres intermolekylære kræfter. Derfor kan de være væsker, der er i stand til at opløse fedt og apolære molekyler, smøremidler eller faste stoffer, der viser mørke farver og kvaliteter som dem af asfalt..
Artikelindeks
- 1 Fysiske og kemiske egenskaber
- 1.1 Polaritet
- 1.2 Intermolekylære interaktioner
- 1.3 Mætning
- 1.4 Stabilitet
- 2 Nomenklatur
- 3 Struktur
- 3.1 Konformationer
- 4 Reaktioner
- 5 anvendelser
- 6 Eksempler på cycloalkaner
- 7 Referencer
Fysiske og kemiske egenskaber
Polaritet
Ved kun at være sammensat af carbonatomer og hydrogenatomer, atomer, der i sig selv ikke adskiller sig for meget i elektronegativitet, gør dette cycloalkanmolekylerne apolare og mangler derfor dipolmoment.
De kan ikke interagere gennem dipol-dipolkræfter, men afhænger specifikt af London-kræfter, som er svage, men øges med molekylær masse. Derfor er små cycloalkaner (med mindre end fem carbonatomer) luftformige..
Intermolekylære interaktioner
På den anden side har cycloalkaner et større kontaktareal, da de er ringe, hvilket favoriserer Londons kræfter mellem deres molekyler. Således grupperer de og interagerer på en bedre måde sammenlignet med alkaner; og dermed er dens kogepunkter og smeltepunkter højere.
Også da de har to færre hydrogenatomer (CnH2n for cycloalkaner og CnH2n + 2 for alkaner), de er lettere; og tilføjer til dette det faktum, at dets større kontaktareal falder, det volumen, der optages af dets molekyler, falder, og derfor er de tættere.
Mætning
Hvorfor klassificeres cycloalkaner som mættede kulbrinter? Fordi de ikke har en måde at inkorporere et brintmolekyle på; medmindre ringen åbnes, i hvilket tilfælde de bliver enkle alkaner. For at et carbonhydrid skal betragtes som mættet, skal det have det maksimalt mulige antal C-H-bindinger.
Stabilitet
Kemisk ligner de meget alkaner. Begge har C-C og C-H obligationer, som ikke er så lette at bryde for at producere andre produkter. Imidlertid varierer deres relative stabilitet, hvilket kan verificeres eksperimentelt ved at måle deres forbrændingsvarme (ΔHkam).
For eksempel når man sammenligner ΔHkam for propan og cyclopropan (repræsenteret af en trekant i billedet) har vi henholdsvis 527,4 kcal / mol og 498,9 kcal / mol.
Detaljen er, at cyclopropanen, baseret på forbrændingsvarmen til alkanerne, skal have en ΔHkam lavere (471 kcal / mol), fordi de er tre methylengrupper, CHto; men i virkeligheden frigiver det mere varme, hvilket afspejler større ustabilitet end estimeret. Denne overskydende energi siges derefter at skyldes belastningerne i ringen..
Og faktisk styrer og spænder disse spændinger reaktiviteten eller stabiliteten af cycloalkaner i forhold til alkaner mod specifikke reaktioner. Så længe belastningerne ikke er meget høje, har cycloalkaner tendens til at være mere stabile end deres respektive alkaner..
Nomenklatur
IUPAC-nomenklaturen for cycloalkaner adskiller sig ikke meget fra den for alkaner. Den enkleste regel af alle er at placere præfikset cyclo- til navnet på alkanen, hvorfra cycloalkanen dannes.
Således for eksempel fra n-hexan, CH3CHtoCHtoCHtoCHtoCH3, du får cyclohexan (repræsenteret af en sekskant i det første billede). Det samme sker med cyclopropan, cyclobutan osv..
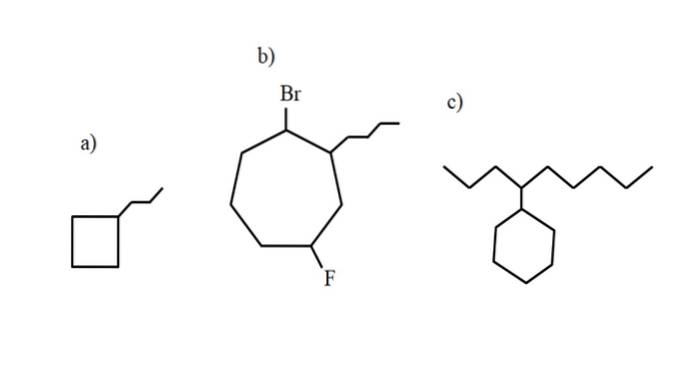
Imidlertid kan disse forbindelser gennemgå substitutioner af et af deres hydrogener. Når antallet af carbonatomer i ringen er større end antallet af alkylsubstituenterne, tages ringen som hovedkæden; dette er tilfældet med a) for billedet ovenfor.
Bemærk, at i a) cyclobutanen (firkanten) har flere carbonatomer end propylgruppen bundet til det; derefter betegnes denne forbindelse som propylcyclobutan.
Hvis der er mere end en substituent, skal de navngives i alfabetisk rækkefølge og på en sådan måde, at de har det lavest mulige lokaliseringsnummer. For eksempel kaldes b): 1-brom-4-fluor-2-butylcycloheptan (og ikke 1-brom-5-fluor-7-butylcycloheptan, hvilket ville være forkert).
Og endelig, når alkylsubstituenten har flere carbonatomer end ringen, siges sidstnævnte at være substituentgruppen i hovedkæden. Således kaldes c): 4-cyclohexylnonan.
Struktur
Bortset fra de substituerede cycloalkaner er det praktisk kun at fokusere på deres strukturelle baser: ringene. Disse blev afbildet i det første billede.
At observere dem kan føre til den falske idé om, at sådanne molekyler er flade; men med undtagelse af cyclopropan er overfladerne "zigzagging", hvor kulstof stiger eller falder i forhold til det samme plan.
Dette skyldes, at alle kulstoffer er hybridiseret til at begynde med.3, og præsenter derfor tetraedriske geometrier med bindingsvinkler på 109,5 °. Men hvis ringens geometri nøje overholdes, er det umuligt, at deres vinkler er disse; for eksempel er vinklerne inden for cyclopropan-trekanten 60º.
Dette er det, der er kendt som vinkelstress. Jo større ringene er, vinklen mellem C-C-bindingerne er tættere på 109,5 °, hvilket forårsager et fald i spændingen og en stigning i stabiliteten for cycloalkanen..
Et andet eksempel observeres i cyclobutan, hvis bindingsvinkler er 90º. Allerede i cyclopentan er dens vinkler 108º, og fra cyclohexan siges det da, at vinkelspændingen holder op med at udøve en så bemærkelsesværdig destabiliserende effekt.
Konformationer
Ud over vinkelspænding er der andre faktorer, der bidrager til den stress, som cycloalkaner oplever..
C-C obligationer kan ikke bare rotere, da dette ville betyde, at hele strukturen ville "ryste". Således kan disse molekyler vedtage meget veldefinerede rumlige konformationer. Formålet med disse bevægelser er at reducere spændinger forårsaget af formørkelsen af brintatomer; det vil sige når de er foran hinanden.
For eksempel ligner konformationer for cyclobutan en sommerfugl, der klapper med vingerne; dem af cyclopentan, en kuvert; dem af cyclohexan, en båd eller stol, og jo større ringen er, jo større antal og former kan de tage i rummet.
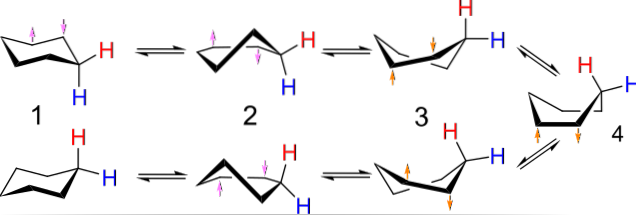
Ovenstående billede viser et eksempel på sådanne konformationer for cyclohexan. Bemærk, at den formodede flade sekskant faktisk ligner en stol (til venstre for billedet) eller en båd (til højre). Et brint er repræsenteret med et rødt bogstav og et andet med et blåt bogstav for at indikere, hvordan deres relative position ændres efter inversionerne..
I (1), når brint er vinkelret på ringens plan, siges det at være i aksial position; og når det er parallelt med dette, siges det at være i ækvatorial position.
Reaktioner
De reaktioner, som cycloalkaner kan gennemgå, er de samme som for alkaner. Begge brænder i nærvær af overskydende ilt i typiske forbrændingsreaktioner for at producere kuldioxid og vand. På samme måde kan begge gennemgå halogeneringer, hvor et hydrogen erstattes af et halogenatom (F, Cl, Br, I).
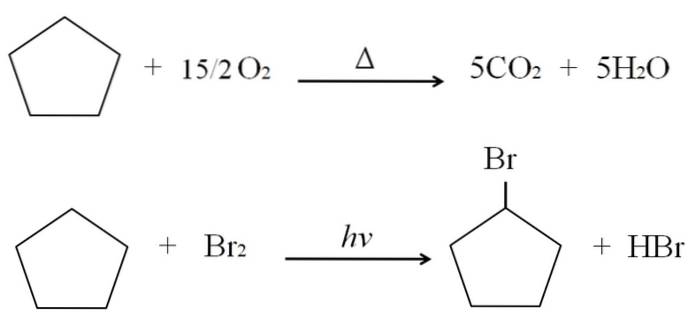
Forbrændings- og halogeneringsreaktionerne for cyclopentan er vist ved hjælp af eksemplet ovenfor. En mol af den brænder i nærvær af varme og 7,5 mol molekylært ilt for at nedbrydes til COto og HtoO. På den anden side, i nærvær af ultraviolet stråling og brom, erstatter det en H for en Br, hvilket frigiver et gasformigt molekyle af HBr.
Ansøgninger
Anvendelsen af cycloalkaner er meget afhængig af deres kulstofantal. De letteste, og derfor gasformige, blev engang brugt til at drive gaslamperne til offentlig belysning.
Væsker har på deres side hjælpeprogrammer som opløsningsmidler til olier, fedtstoffer eller kommercielle produkter af ikke-polær karakter. Blandt disse kan nævnes cyclopentan, cyclohexan og cycloheptan. Ligeledes har de en tendens til at blive brugt meget ofte i rutinemæssige operationer i petroleumslaboratorier eller i formuleringen af brændstoffer..
Hvis de er tungere, kan de bruges som smøremidler. På den anden side kan de også repræsentere udgangsmaterialet til syntesen af lægemidler; såsom carboplatin, som inkluderer en cyclobutanring i sin struktur.
Eksempler på cycloalkaner
Endelig vender vi tilbage til begyndelsen af artiklen: billedet med flere usubstituerede cycloalkaner.
For at huske cycloalkaner skal du bare tænke på de geometriske figurer: trekant (cyclopropan), firkant (cyclobutan), pentagon (cyclopentan), hexagon (cyclohexan), heptagon (cycloheptan), decagon (cyclodecan), pentadecagon (cyclopentadecan) og så videre..
Jo større ringen er, desto mindre ligner den sin respektive geometriske figur. Det er allerede set, at cyclohexan er alt andet end en sekskant; det samme er mere tydeligt med cyclotetradecan (fjorten carbonatomer).
Der kommer et punkt, hvor de opfører sig som halskæder, der kan foldes for at reducere belastningen af deres led og formørkelse så meget som muligt..
Referencer
- Morrison, R. T. og Boyd, R, N. (1987). Organisk kemi. 5. udgave. Redaktionel Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kemi. (Sjette udgave). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10. udgave.). Wiley plus.
- Kemi LibreTexts. (2. juni 2019). Navngivning af cycloalkaner. Gendannet fra: chem.libretexts.org
- Wikipedia. (2019). Cycloalkane. Gendannet fra: en.wikipedia.org
- Clark Jim. (2015). Introduktion af alkaner og cycloalkaner. Gendannet fra: chemguide.co.uk
- James Ashenhurst. (2019). Konformationer og cycloalkaner. Master organisk kemi. Gendannet fra: masterorganicchemistry.com
- Fernández Germán. (s.f.). Cycloalkanes-teori. Organisk kemi. Gendannet fra: quimicaorganica.org



Endnu ingen kommentarer