
Kromsyrestruktur, egenskaber, produktion, anvendelser

Det kromsyre eller HtoCrO4 det er teoretisk den syre, der er forbundet med chrom (VI) -oxid eller chromoxid CrO3. Dette navn skyldes, at arten HtoCrO4 er til stede sammen med andre arter af krom (VI).
Chromoxid CrO3 det kaldes også vandfri kromsyre. CrO3 er et rødbrunt eller lilla fast stof, der opnås ved behandling af opløsninger af kalium K-dichromattoCrtoELLER7 med svovlsyre HtoSW4.

Vandige chromoxidopløsninger oplever en ligevægt mellem visse kemiske arter, hvis koncentration afhænger af opløsningens pH. Ved basisk pH dominerer kromationerne CrO4to-, mens HCrO-ionerne dominerer ved sur pH4- og Cr-dikromattoELLER7to-. Det anslås, at chromsyre H også er til stede ved sur pHtoCrO4.
På grund af deres store oxidationsevne anvendes kromsyreopløsninger i organisk kemi til at udføre oxidationsreaktioner. De bruges også i elektrokemiske processer til behandling af metaller på en måde, der gør dem modstandsdygtige over for korrosion og slid..
Visse polymere materialer behandles også med kromsyre for at forbedre deres vedhæftning til metaller, maling og andre stoffer..
Kromsyreopløsninger er meget farlige for mennesker, de fleste dyr og miljøet. Af denne grund behandles flydende eller fast affald fra processer, hvor der anvendes kromsyre, for at fjerne spor af krom (VI) eller for at genvinde alt det tilstedeværende krom og regenerere kromsyren til genbrug..
Artikelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 egenskaber
- 3.1 Fysisk tilstand
- 3.2 Molekylvægt
- 3.3 Smeltepunkt
- 3.4 Tæthed
- 3.5 Opløselighed
- 3.6 Andre egenskaber
- 4 Kemi af vandige opløsninger, hvor chrominsyre er til stede
- 5 Opnåelse
- 6 Anvendelse af kromsyre
- 6.1 I oxidation af kemiske forbindelser
- 6.2 I metalanodiseringsprocesser
- 6.3 I kemiske konverteringsbehandlinger
- 6.4 På eroderede eller udstenede overflader
- 6.5 I forskellige anvendelser
- 7 Gendannelse af kromsyre
- 7.1 Ved hjælp af harpikser
- 7.2 Ved elektrokemisk regenerering
- 8 Anvendelse af mikroorganismer til at rense spildevand med spor af kromsyre
- 9 Risici for kromsyre og kromoxid
- 10 Referencer
Struktur
Kromsyremolekyle HtoCrO4 den er dannet af en kromation CrO4to- og to hydrogenioner H+ knyttet til dette. I chromationen er elementet Chrom i en oxidationstilstand på +6.
Den rumlige struktur af chromationen er tetraeder, hvor krom er i midten og oxygener optager de fire hjørner af tetraedret..
I kromsyre er hydrogenatomer hver sammen med et ilt. Af de fire chrombindinger med iltatomerne er to dobbelt og to enkle, da de har hydrogenerne knyttet til sig.
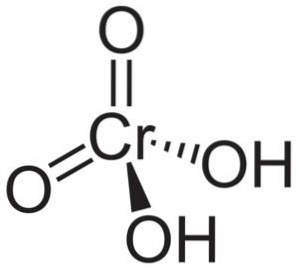
På den anden side er chromoxid CrO3 har et kromatom i +6 oxidationstilstand omgivet af kun tre iltatomer.
Nomenklatur
- Kromsyre HtoCrO4
- Tetraoxochromsyre HtoCrO4
- Kromoxid (vandfri kromsyre) CrO3
- Chromtrioxid (vandfri kromsyre) CrO3
Ejendomme
Fysisk tilstand
Vandfri kromsyre eller kromoxid er et lilla til rødt krystallinsk fast stof
Molekylær vægt
CrO3: 118,01 g / mol
Smeltepunkt
CrO3: 196 ºC
Over dets smeltepunkt er det termisk ustabilt, det mister ilt (reduceres) for at give chrom (III) oxid CrtoELLER3. Den nedbrydes ved ca. 250 ºC.
Massefylde
CrO3: 1,67-2,82 g / cm3
Opløselighed
CrO3 det er meget opløseligt i vand: 169 g / 100 g vand ved 25 ºC.
Det er opløseligt i mineralsyrer som svovlsyre og salpetersyre. Opløselig i alkohol.
Andre egenskaber
CrO3 det er meget hygroskopisk, dets krystaller er delikat.
Når CrO3 opløses i vand og danner stærkt sure opløsninger.
Det er en meget kraftig oxidant. Oxiderer organisk materiale kraftigt i næsten alle dets former. Angriber stof, læder og noget plast. Angriber også de fleste metaller.
Det er stærkt giftigt og meget irriterende på grund af dets høje oxidationspotentiale..
Kemi af vandige opløsninger, hvor chrominsyre er til stede
Chromoxid CrO3 opløses hurtigt i vand. I vandig opløsning kan chrom (VI) eksistere under forskellige ionformer.
Ved pH> 6,5 eller i en alkalisk opløsning erhverver chrom (VI) chromationformen CrO4to- gul.
Hvis pH sænkes (1 < pH < 6,5) el cromo (VI) forma principalmente el ion HCrO4- , som kan dimere til Cr-dichromationtoELLER7to-, og opløsningen bliver orange. Ved pH mellem 2,5 og 5,5 er den dominerende art HCrO4- og CRtoELLER7to-.

Balancerne, der opstår i disse opløsninger, når pH-værdien falder, er følgende:
CrO4to- (kromation) + H+ ⇔ HCrO4-
HCrO4- + H+ ⇔ HtoCrO4 (kromsyre)
2HCrO4- ⇔ CrtoELLER7to- (dichromation) + HtoELLER
Disse balancer forekommer kun, hvis den syre, der tilsættes for at sænke pH, er HNO3 eller HClO4, fordi der med andre syrer dannes forskellige forbindelser.
Sure dichromatopløsninger er meget stærke oxidationsmidler. Men i alkaliske opløsninger er kromationen meget mindre oxiderende.
Opnåelse
Ifølge de kilder, der er hørt, er en af måderne at opnå kromoxid CrO3, Dette består i at tilsætte svovlsyre til en vandig opløsning af natrium eller kaliumdichromat og danne et rødorange bundfald..

Kromsyre HtoCrO4 Det findes i vandige opløsninger af chromoxid i et surt medium.
Kromsyre bruger
I oxidation af kemiske forbindelser
På grund af sin stærkt oxiderende evne er kromsyre længe blevet brugt med succes til at oxidere organiske og uorganiske forbindelser..
Blandt utallige eksempler er følgende: det tillader oxidation af primære alkoholer til aldehyder og disse til carboxylsyrer, sekundære alkoholer til ketoner, toluen til benzoesyre, ethylbenzen til acetophenon, triphenylmethan til triphenylcarbinol, myresyre til COto, oxalsyre til COto, mælkesyre til acetaldehyd og COto, jernholdig Feto+ til jernion Fe3+, iodid til jod osv.
Det tillader omdannelse af nitrosoforbindelser til nitroforbindelser, sulfider til sulfoner. Det er involveret i syntesen af ketoner startende fra alkener, da det oxiderer hydroborerede alkener til ketoner.
Forbindelser, der er meget resistente over for almindelige oxidanter, såsom oxygen Oto eller hydrogenperoxid HtoELLERto, de oxideres af kromsyre. Dette er tilfældet for visse heterocykliske boraner.
I metalanodiseringsprocesser
Kromsyreanodisering er en elektrokemisk behandling, der anvendes på aluminium for at beskytte den i mange år mod oxidation, korrosion og slid..
Anodiseringsprocessen involverer den elektrokemiske dannelse af et lag aluminiumoxid eller aluminiumoxid på metallet. Dette lag forsegles derefter i varmt vand, hvormed omdannelsen til aluminiumoxidtrihydrat opnås..
Det forseglede oxidlag er tykt, men strukturelt svagt og ikke særlig tilfredsstillende til efterfølgende klæbende binding. Tilføjelse af en lille mængde kromsyre til forseglingsvandet udvikler imidlertid en overflade, der kan danne gode bindinger..
Kromsyren i forseglingsvandet opløser en del af den grove cellelignende struktur og efterlader et tyndt, stærkt, fastgjort lag af aluminiumoxid, som klæbemidlet klæber til og danner stærke og holdbare bindinger..
Anodisering af kromsyre gælder også for titanium og dets legeringer.
I kemiske konverteringsbehandlinger
Kromsyre anvendes i metalcoatingprocesser ved kemisk omdannelse.
Under denne proces nedsænkes metaller i kromsyreopløsninger. Dette reagerer og opløser delvist overfladen, mens det deponerer et tyndt lag af komplekse chromforbindelser, der interagerer med basismetallet..
Denne proces kaldes kromatkonverteringsbelægning eller konvertering forkromning..
Metallerne, der generelt udsættes for konvertering forkromning er forskellige typer stål, såsom kulstofstål, rustfrit stål og zinkbelagt stål, og forskellige ikke-jernholdige metaller, såsom magnesiumlegeringer, tinlegeringer, aluminiumlegeringer, kobber. , cadmium, mangan og sølv.
Denne behandling giver korrosionsbestandighed og glans til metallet. Jo højere pH i processen, jo større er korrosionsbestandigheden. Temperatur accelererer syrereaktionen.
Belægninger i forskellige farver kan anvendes, såsom blå, sort, guld, gul og klar. Det giver også bedre vedhæftning af metaloverfladen til maling og lim.
På eroderede eller udgravede overflader
Kromsyreopløsninger anvendes til fremstilling af overfladen af genstande fremstillet af termoplastisk materiale, termohærdende polymerer og elastomerer til deres efterfølgende belægning med maling eller klæbemiddel..
HtoCrO4 det har en effekt på overfladens kemi og dets struktur, da det hjælper med at øge dets ruhed. Kombinationen af pitting og oxidation øger limenes indtrængning og kan endda forårsage ændringer i polymerens egenskaber..
Det er blevet brugt til at erodere forgrenet lavdensitetspolyethylen, lineær højdensitetspolyethylen og polypropylen.
Det bruges i vid udstrækning i galvaniserings- eller galvaniseringsindustrien for at lette vedhæftning af metal-polymer.
I forskellige anvendelser
Kromsyre bruges som træbeskyttelsesmiddel, også i magnetiske materialer og til katalyse af kemiske reaktioner.
Gendannelse af kromsyre
Der er mange processer, der bruger kromsyre og genererer strømme eller rester, der indeholder krom (III), som ikke kan bortskaffes, fordi de har krom (VI) -ioner, der er meget giftige, og de kan heller ikke genbruges, fordi koncentrationen af kromationer er meget lav..
Deres bortskaffelse kræver kemisk reduktion af kromater til krom (III) efterfulgt af udfældning af hydroxidet og filtrering, hvilket genererer yderligere omkostninger.
Af denne grund er forskellige metoder blevet undersøgt for at fjerne og genvinde kromater. Her er nogle af disse.
Ved hjælp af harpikser
Ionbytterharpikser har været anvendt i mange år til behandling af vand forurenet med kromater. Dette er en af de behandlinger, der er godkendt af US Environmental Protection Agency eller EPA. Miljøstyrelsen).
Denne metode tillader genvinding af koncentreret kromsyre, da den regenereres igen fra harpiksen..
Harpikserne kan være stærke eller svage. I stærkt basiske harpikser kan kromaten fjernes, fordi HCrO-ionerne4- og CRtoELLER7to- udveksles med OH-ioner- og Cl-. I svagt basiske harpikser, for eksempel sulfatharpikser, udveksles ioner med SO4to-.
I tilfælde af de stærkt basiske R- (OH) harpikser er de samlede reaktioner som følger:
2ROH + HCrO4- + H+ ⇔ RtoCrO4 + 2HtoELLER
RtoCrO4 + 2HCrO4- ⇔ 2RHCrO4 + CrO4to-
RtoCrO4 + HCrO4- + H+ ⇔ RtoCrtoELLER7 + HtoELLER
For hver mol af RtoCrO4 konverteret fjernes en mol Cr (VI) fra opløsningen, hvilket gør denne metode meget attraktiv..
Efter fjernelse af kromaterne behandles harpiksen med en stærkt alkalisk opløsning for at regenerere dem et sikkert sted. Derefter omdannes kromaterne til koncentreret kromsyre, der skal genbruges..
Gennem elektrokemisk regenerering
En anden metode er elektrokemisk regenerering af kromsyre, som også er et meget praktisk alternativ. Ved denne proces oxideres krom (III) anodisk til krom (VI). Anodematerialet er i disse tilfælde fortrinsvis blydioxid..
Brug af mikroorganismer til at rense spildevand med spor af kromsyre
En metode, der er blevet undersøgt og stadig undersøges, er anvendelsen af mikroorganismer, der er naturligt til stede i visse spildevand, der er kontamineret med hexavalente chromioner, som er dem, der er indeholdt i kromsyreopløsninger..

Dette er tilfældet med visse bakterier til stede i spildevand til lædergarvning. Disse mikrober er blevet undersøgt, og det er blevet bestemt, at de er resistente over for kromater og også er i stand til at reducere krom (VI) til krom (III), som er meget mindre skadeligt for miljøet og levende væsener..
Af denne grund skønnes det, at de kan bruges som en miljøvenlig metode til sanering og afgiftning af spildevand, der er forurenet med spor af kromsyre..
Fare for kromsyre og kromoxid
CrO3 Det er ikke brændbart, men det kan intensivere forbrændingen af andre stoffer. Mange af deres reaktioner kan forårsage brand eller eksplosion.
CrO3 og kromsyreopløsninger er potente irriterende for huden (kan forårsage dermatitis), øjne (kan brænde) og slimhinder (kan forårsage bronchoasma) og kan forårsage såkaldte "chromhuller" i åndedrætssystemet.
Krom (VI) -forbindelser som chromsyre og chromoxid er alvorligt giftige, mutagene og kræftfremkaldende for de fleste levende ting..
Referencer
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avanceret uorganisk kemi. Fjerde udgave. John Wiley & Sons.
- OS. National Library of Medicine. (2019). Kromsyre. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Wegman, R.F. og Van Twisk, J. (2013). Aluminium og aluminiumslegeringer. 2.5. Kromsyreanodiseringsproces. In Surface Preparation Techniques for Adhesive Bonding (Anden udgave). Gendannet fra sciencedirect.com.
- Wegman, R.F. og Van Twisk, J. (2013). Magnesium. 6.4. Fremstilling af magnesium- og magnesiumlegeringer ved behandling af kromsyre. In Surface Preparation Techniques for Adhesive Bonding (Anden udgave). Gendannet fra sciencedirect.com.
- Grot, W. (2011). Ansøgninger. 5.1.8. Regenerering af kromsyre. In Fluorinated Ionomers (Anden udgave). Gendannet fra sciencedirect.com.
- Swift, K.G. og Booker, J.D. (2013). Overfladetekniske processer. 9.7. Kromatering. I håndbog til valg af fremstillingsprocesser. Gendannet fra sciencedirect.com.
- Poulsson, A.H.C. et al. (2019). Overflademodifikationsteknikker for PEEK, inklusive plasmaoverfladebehandling. 11.3.2.1. Overfladeætsning. I PEEK Biomaterials Handbook (Anden udgave). Gendannet fra sciencedirect.com.
- Westheimer, F.H. (1949). Mekanismerne for kromsyreoxidationer. Kemiske anmeldelser 1949, 45, 3, 419-451. Gendannet fra pubs.acs.org.
- Tan, H.K.S. (1999). Fjernelse af kromsyre fra Anion Exchange. The Canadian Journal of Chemical Engineering, bind 77, februar 1999. Gendannet fra onlinelibrary.wiley.com.
- Kabir, M.M. et al. (2018). Isolering og karakterisering af chrom (VI) -reducerende bakterier fra garveriudløb og fast affald. World Journal of Microbiology and Biotechnology (2018) 34: 126. Gendannet fra ncbi.nlm.nih.gov.


Endnu ingen kommentarer