
Stærke og svage syrer og baser

En klassificering af syrer og baser inden for kemi afhænger af ioniseringskraften af disse stoffer i vandigt medium. A) Ja:
- -en syre og en base er stærke når de er fuldstændigt ioniserede, dvs. i ioniseringsprocessen transformeres de fuldstændigt til kationer eller positive ioner og til anioner eller negative ioner.
- På den anden side, en syre og en base er svage når de delvist ioniseres i vand, det vil sige i opløsning, vil der være en andel af kationer, en anden andel af anioner og en anden andel af ikke-dissocierede molekyler.
| Stærke syrer og baser | Svage syrer og baser | |
|---|---|---|
| Definition | Stoffer, der fuldstændigt ioniserer i opløsning. | Stoffer, der delvis ioniserer i opløsning. |
| Ionisering | Komplet | Delvis |
| Elementer i vandig opløsning | Kationer og anioner i samme koncentration. | Kationer, anioner og molekyler i forskellige proportioner. |
| Ioniseringskonstant | Forhøjet | Lille |
| Eksempler |
|
|
Stærke syrer og baser
EN syre eller en base er stærke, når de adskilles fuldstændigt i et vandigt medium, dvs. ioniseringsprocessen er afsluttet, og opløsningen vil have den samme koncentration af anioner som kationer.
Hvordan ioniserer du en syre og en stærk base??
En stærk syre, såsom saltsyre HCI, ioniserer på følgende måder:
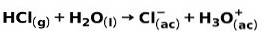
En stærk base, såsom natriumhydroxid NaOH, ioniserer på følgende måder:
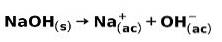
Eksempler på stærke syrer og deres formler
| Stærke syrer | Formel |
|---|---|
| Saltsyre | HCI |
| Svovlsyre | HtoSW4 |
| Salpetersyre | HNO3 |
| Hydrobromsyre | HBr |
| Perchlorsyre | HC14 |
| Kromsyre | HtoCrO4 |
| Tetrafluroborsyre | HBF4 |
Eksempler på stærke baser og deres formler
| Stærk base | Formel |
|---|---|
| Natriumhydroxid | NaOH |
| Lithiumhydroxid | LiOH |
| Kaliumhydroxid | KOH |
| Rubidiumhydroxid | RbOH |
| Cæsiumhydroxid | CsOH |
| Calciumhydroxid | Ca (OH)to |
| Bariumhydroxid | Ba (OH)to |
| Strontiumhydroxid | Sr (OH)to |
| Aluminiumhydroxid | Al (OH)3 |
Du kan være interesseret i at se flere eksempler på syrer og baser.
Svage syrer og baser
EN Syre eller base er svag, når den delvist er ioniseret i vandig opløsning, i løsningen er der ioner og ikke-ioniserede molekyler.
Hvordan ioniserer du en syre og en svag base??
En svag syre, såsom eddikesyre CH3COOH, er ioniseret på følgende måde:
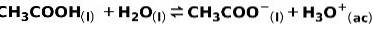
Ligevægten ved denne reaktion udtrykkes af de to pile i modsatte retninger.
Når en svag syre dissocieres eller ioniseres, etableres en ligevægt mellem de arter, der er til stede i opløsningen; dette kan udtrykkes ved en ioniseringskonstant sur:
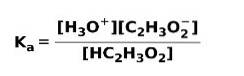
Ioniseringskonstanten er intet andet end forholdet mellem multiplikation af koncentrationen af produkterne over multiplikationen af koncentrationen af reaktanterne.
En svag base, såsom NH-ammoniak3, ioniserer på følgende måde:
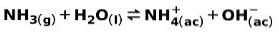
Når en svag base dissocieres eller ioniseres, etableres en ligevægt mellem de arter, der er til stede i opløsningen; dette kan udtrykkes ved en baseioniseringskonstant:
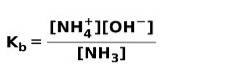
Du kan være interesseret i at kende forskellen mellem syrer og baser.
Eksempler på svage syrer med deres formel og syreioniseringskonstant Ktil
| Svag syre | Formel | Ioniseringskonstant |
|---|---|---|
| Myresyre | HtoCOto | 1,77 x 10-4 |
| Eddikesyre | H3CCOH | 1,75 x 10-5 |
| Hydrocyansyre | HOCN | 3,30 x 10-4 |
| Hydrogencyanid | HCN | 6,20 x 10-10 |
| Hypochlorsyre | HOCl | 3,50 x 10-8 |
| Salpetersyre | HNOto | 4,00 x 10-4 |
| Mælkesyre | HC3H5ELLER3 | 1,40 x 10-4 |
| Kulsyre | HtoCO3 | 4,30 x 10-7 5,60 x 10-elleve |
| Borsyre | H3BO3 | 5,80 x 10-10 1,80 x 10-13 3,00 x 10-14 |
Eksempler på svage baser med deres formel og grundlæggende ioniseringskonstant Kb
| Svag base | Formel | Ioniseringskonstant |
|---|---|---|
| Ammoniak | NH3 | 1,75 x 10-5 |
| Methylamin | CH3NHto | 4,38 x 10-4 |
| Ethylamin | CtoH5NHto | 5,60 x 10-4 |
| Aniline | C6H5NHto | 3,80 x 10-10 |
| Pyridin | C5H5N | 1,70 x 10-9 |
| Benzylamin | C7H9N | 2,20 x 10-5 |
| Natriumbicarbonat | NaHCO | 2,00 x 10-4 |
Du kan være interesseret i at vide mere om syrer og basers egenskaber



Endnu ingen kommentarer