
Natriumcitrat (C6H5O7Na3) struktur, anvendelser, egenskaber
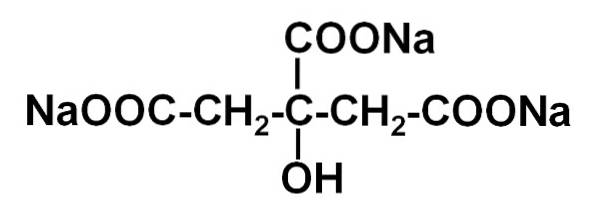
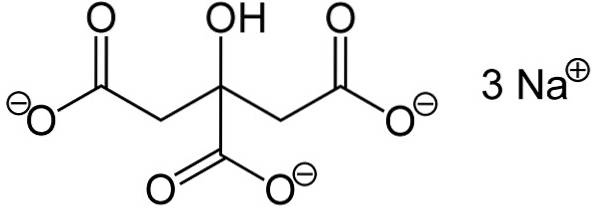
Det natriumcitrat Det er natriumsaltet af citronsyre. Det er dannet af en citratanion C6H5ELLER73- og tre natrium-Na-kationer+. Dens molekylformel er C6H5ELLER7Na3 eller i dens udvidede form: NaOOC-CHto-C (COONa) (OH) -CHto-COONa. Natriumcitrat er konjugatbasen af citronsyre, dvs. det opnås teoretisk fra sidstnævnte ved at erstatte hvert H-proton+ af -COOH for en natrium-Na+.
Det kan fremstilles i vandfri form (uden vand i dets sammensætning) eller i dets hydratiserede form med 2 eller 5 vandmolekyler. Det er en forbindelse, der, når vandfri (uden vand) har en tendens til at absorbere vand fra miljøet.
Natriumcitrat fungerer som en buffer, hvilket betyder, at det stabiliserer pH, som er et mål for surhedsgraden eller basiskheden af en vandig opløsning. Det har også den egenskab at danne en stabil forbindelse med calcium Ca-ioner.to+, calciumcitrat.
Det bruges i fødevareindustrien for eksempel for at forhindre komælk i at danne klumper, der er svære for spædbørn at fordøje.
I bioanalyselaboratorier bruges det til at forhindre blod, der trækkes fra patienter til bestemte tests, at størkne. Det forhindrer også blod, der bruges i transfusioner, i at størkne. Det bruges i vid udstrækning i fosfatfrie vaskemidler, fordi det ikke forurener.
Artikelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 egenskaber
- 3.1 Fysisk tilstand
- 3.2 Molekylvægt
- 3.3 Smeltepunkt
- 3.4 Opløselighed
- 3,5 pH
- 3.6 Kemiske egenskaber
- 3.7 Andre egenskaber
- 4 Opnåelse
- 4.1 Placering i naturen
- 5 anvendelser
- 5.1 I fødevareindustrien
- 5.2 I medicin
- 5.3 I medicinalindustrien
- 5.4 I blodprøver
- 5.5 I syntesen af nanopartikler
- 5.6 I miljøvenlige rengøringsmidler
- 5.7 Til forbedring af udnyttelsen af tjæresand
- 5.8 I andre applikationer
- 6 Referencer
Struktur
Trinatriumcitrat består af tre natrium-Na-ioner+ og en citration.
Citrationen består af en kæde med tre carbonatomer, hvortil 3 carboxylater er bundet -COO- (en for hvert carbonatom) og en hydroxyl-OH ved det centrale carbon.
Hver af de 3 Na-ioner+ er knyttet til en -COO-gruppe-.
Nomenklatur
- Natriumcitrat
- Trinatriumcitrat
- Trinatrium 2-hydroxypropan-1,2,3-tricarboxylat
Ejendomme
Fysisk tilstand
Hvidt eller farveløst krystallinsk fast stof.
Molekylær vægt
258,07 g / mol
Smeltepunkt
300 ºC
Opløselighed
Det er meget opløseligt i vand: 42,5 g / 100 ml ved 25 ºC. Det er praktisk talt uopløseligt i alkohol.
pH
En 5% vandig opløsning af natriumcitrat har en pH mellem 7,5 og 9,0, det vil sige, den er let basisk.
Kemiske egenskaber
Natriumcitrat er en buffer, hvilket betyder, at det stabiliserer pH, som er et mål for surhedsgraden eller alkaliniteten i en vandig opløsning. Ved at stabilisere pH tillader citrat ikke opløsningen at forsures eller alkaliseres over bestemte værdier.
Når der er overskydende protoner H+ tager dem til at konvertere deres -COO grupper- i -COOH-grupper. Omvendt, hvis der er mange OH-grupper- opgiver protonerne i deres -COOH-grupper og konverterer dem til -COO-.
Når det transformeres af kroppen, tilvejebringer det 3 HCO-molekyler3- for hvert citratmolekyle.
Andre egenskaber
Dens krystaller er lækker, dvs. de absorberer vand fra luften. Natriumcitratdihydrat er mere stabil i luften.
Hvis dihydratet opvarmes, når det når 150 ºC, bliver det vandfrit (uden vand).
Ligesom citronsyre smager natriumcitrat surt.
Opnåelse
Natriumcitrat fremstilles normalt ved at tilsætte natriumcarbonat til en citronsyreopløsning, indtil brusningen ophører. Brusningen skyldes udviklingen af kuldioxid COto:
NatoCO3 + Citronsyre → Natriumcitrat + COto↑
Derefter fordampes vandet fra opløsningen for at krystallisere produktet.
Det kan også fremstilles ved behandling af en natriumsulfatopløsning med calciumcitrat:
NatoSW4 + Calciumcitrat → Natriumcitrat + CaSO4↓
Opløsningen filtreres for at fjerne CaSO4 fast stof, der er udfældet. Derefter koncentreres opløsningen, og således krystalliserer natriumcitratet.
Placering i naturen
Natriumcitrat er den konjugerede base af citronsyre, som er en naturlig forbindelse, der findes i alle levende organismer, da den er en del af deres stofskifte, som er mekanismen til at udvikle energi i celler..
Ansøgninger
I fødevareindustrien
Natriumcitrat har forskellige anvendelser i fødevareindustrien, for eksempel som en surhedsregulator, sekvestrerende, stabilisator, overfladeaktivt middel eller emulgator..
Det bruges blandt andet i drinks, frosne desserter og specielle oste.
Det gør det muligt at undgå koagulation af mælk, så den tilsættes til komælk, der bruges til fodring af ammende børn. På denne måde dannes ikke blodpropper eller hårde ostemasse, der er svære at fordøje, af maven hos børn..

Det bruges til at fremskynde farvefiksering i hærdet svinekød eller oksekød, det vil sige kød, der er blevet behandlet for at forhindre ødelæggelse. Op til 50% ascorbinsyre udskiftes i disse.

Det bruges også til at forhindre blodpropper i fersk oksekød (såsom bøffer).
I medicin
Det bruges som et alkaliserende middel, da det neutraliserer overskydende syre i blodet og urinen. Det er indiceret til behandling af metabolisk acidose, der opstår, når kroppen producerer for meget syre.
Når det er indtaget, bliver citrationen til bicarbonation, som er et systemisk alkaliserende middel (dvs. af hele organismen), og som en konsekvens neutraliseres H-ionerne.+, øger blodets pH og vender eller eliminerer acidose.
Natriumcitrat fungerer som et neutraliserende middel til mavebesvær.
Det bruges som en slimløsende og sudorificerende. Det har vanddrivende virkning. Øger udskillelsen af calcium i urinen, hvorfor det bruges i hyperkalcæmi, hvilket er når der er et overskud af calcium i blodet.
Det tjener også til at lette fjernelse af bly, når der forekommer blyforgiftning..
Hvis det administreres i overskud, kan det forårsage alkalose, muskelspasmer på grund af funktionsfejl i parathyroidea og depression af hjertefunktion på grund af et fald i niveauet af calcium i blodet, blandt andre symptomer..
Natriumcitrat anvendes i transfusioner. Det tilsættes til blodet sammen med dextrose for at forhindre, at det størkner.
Normalt metaboliserer leveren hurtigt citratet opnået i transfusionen, men under transfusioner af store mængder kan leverens kapacitet blive overskredet..
I sådanne tilfælde, da citrat danner et kompleks med calcium, resulterer et fald i calciumionen Ca.to+ i blodet. Dette kan føre til svimmelhed, rysten, prikken osv. Derfor skal transfusioner udføres langsomt.
I medicinalindustrien
Blandt mange andre anvendelser bruges det til at forhindre mørkfarvning af stoffer, hvor der er jern og tanniner.
I blodprøver
Det bruges som et antikoagulant i blodopsamling, eller når det skal opbevares, da det fungerer som en chelator af calcium Ca-ionerto+, det vil sige, det binder til calciumioner, der danner calciumcitrat, som ikke er ioniseret.
Det bruges til koagulationstest og til bestemmelse af sedimentationshastigheden for røde blodlegemer..
Det bruges som et antikoagulant under plasmaferese, en procedure til fjernelse af overskydende stoffer, der er skadelige for kroppen fra blodet..
I syntesen af nanopartikler
Det bruges som en stabilisator i syntesen af guld nanopartikler. Trinatriumcitratdihydrat tilsættes til kloraursyre og danner en vinrød suspension..
Natriumcitrat tjener som et reduktionsmiddel og som et antiblodplademiddel, da det adsorberes på nanopartiklerne..
På grund af den negative ladning af citrat frastøder partiklerne hinanden og undgår agglomerering og danner en stabil dispersion. Jo højere citratkoncentrationen er, jo mindre er partiklerne..
Disse nanopartikler bruges til at forberede medicinske biosensorer.
I miljøvenlige rengøringsmidler
Natriumcitrat anvendes i vid udstrækning i fosfatfrie flydende vaskemidler. Dette skyldes, at dets miljømæssige adfærd er harmløs, da det er en metabolit, der findes i alle levende organismer..
Det er let biologisk nedbrydeligt og svagt giftigt for vandlevende organismer. Af denne grund anses det for at være et rengøringsmiddel med økologisk gunstige egenskaber..
Til forbedring af udnyttelsen af tjæresand
Oliesand er sandformationer rig på bitumen eller tjære, et materiale der ligner råolie.
Natriumcitrat er testet med succes i forbindelse med natriumhydroxid NaOH for at ekstrahere olie fra tjæresand.
Det antages, at -COO-ionerne ved at forbinde citratet med sandstenen- Citrat danner et stort antal negative ladninger på silicapartikler. Dette frembringer en bedre adskillelse af sandet fra bitumen ved simpel afvisning af grusens negative ladninger fra bitumenens negative ladninger.
I andre applikationer
Det bruges til fotografering, til at fjerne spormetaller, til galvanisering og til at fjerne SOto affaldsgasser.
Referencer
- OS. National Library of Medicine. (2019). Natriumcitrat. Gendannet fra: pubchem.ncbi.nlm.nih.gov.
- McNamara, C. (2017). Indsamling og håndtering af blod. I Dacie og Lewis Praktisk hæmatologi (tolvte udgave). Gendannet fra sciencedirect.com.
- Steber, J. (2007). Økotoksiciteten af rengøringsproduktingredienser. I håndbog til rengøring / dekontaminering af overflader. Gendannet fra sciencedirect.com.
- Xiang, B. et al. (2019). Undersøgelse af natriumcitratets rolle i frigivelse af bitumen. Energi brændstoffer 2019, 33, 8271-8278. Gendannet fra pubs.acs.org.
- Heddle, N. og Webert, K.E. (2007). Transfusionsmedicin. In Blood Banking and Transfusion Medicine (Anden udgave). Gendannet fra sciencedirect.com.
- Sudhakar, S. og Santhosh, P.B. (2017). Guld nanomaterialer. Fremskridt inden for biomembraner og lipidselvmontering. Gendannet fra sciencedirect.com.
- Elsevier (redaktionel) (2018). Kapitel 8. Nanometal. I grundlæggende og anvendelser af nanosilicium i plasma og fulleriner. Nuværende og fremtidige tendenser Micro og Nano Technologies. Sider 169-203. Gendannet fra sciencedirect.com.


Endnu ingen kommentarer