
Chromchlorid (CrCl3) struktur, egenskaber, anvendelser
Det chromchlorid (CrCl3) er et uorganisk salt sammensat af Cr-kationer3+ og Cl-anioner- i forholdet 1: 3; det vil sige for hver Cr3+ der er tre Cl-. Som det vil ses senere, er deres interaktioner ikke ioniske. Dette salt kan præsenteres i to former: vandfri og hexahydrat..
Den vandfrie form er karakteriseret ved at have en rød-violet farve; mens hexahydratet, CrCl3.6HtoEller det er mørkegrønt. Inkorporeringen af vandmolekylerne modificerer de fysiske egenskaber af krystallerne; såsom deres kogepunkter og smeltepunkter, densiteter osv..

Krom (III) chlorid (i henhold til stamnomenklaturen) nedbrydes ved høje temperaturer og omdannes til krom (II) chlorid, CrClto. Det er ætsende for metaller, selvom det bruges i forkromning: en procedure, hvor metaller er belagt med et tyndt lag krom.
Cr3+, Kommer fra dets respektive klorid, er det blevet brugt til behandling af diabetes, især hos patienter med total parenteral ernæring (TPN), der ikke indtager den krævede mængde krom. Resultaterne er dog meget bedre (og mere pålidelige), hvis de leveres som picolinat..
Artikelindeks
- 1 Struktur af kromchlorid
- 1.1 Krystallinske lag vandfri
- 2 egenskaber
- 2.1 Navne
- 2.2 Kemisk formel
- 2.3 Molekylvægt
- 2.4 Fysisk beskrivelse
- 2.5 Smeltepunkt
- 2.6 Kogepunkt
- 2.7 Opløselighed i vand
- 2.8 Opløselighed i organiske opløsningsmidler
- 2.9 Densitet
- 2.10 Opbevaringstemperatur
- 2.11 Nedbrydning
- 2.12 Korrosion
- 2.13 Reaktioner
- 2,14 pH
- 3 Syntese
- 4 anvendelser
- 4.1 Industriel
- 4.2 Terapeutiske midler
- 5 risici
- 6 Referencer
Chromchloridstruktur
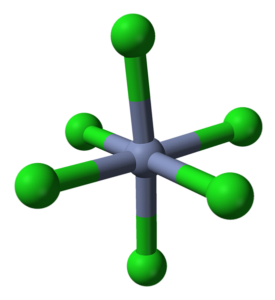
CrCl3 På trods af at det er et salt, er arten af dets interaktioner ikke rent ionisk; har en vis kovalent karakter, produkt af koordineringen mellem Cr3+ og Cl-, som giver anledning til en deformeret oktaeder (øverste billede). Krom er placeret i midten af oktaeder og klor i sine hjørner.
Oktahedronen CrCl6 kan ved første øjekast modsige CrCl-formlen3; dog definerer denne komplette oktaeder ikke krystalens enhedscelle, men snarere en terning (også deformeret), der skærer de grønne kugler eller kloranioner i halve.
Vandfri krystallinske lag
Enhedscellen med denne oktaeder holder således stadig forholdet 1: 3. Ved at gengive disse deformerede terninger i rummet opnås CrCl-krystallen3, som er repræsenteret i det øverste billede med en tredimensionel udfyldningsmodel og en model af kugler og stænger.

Dette krystallinske lag er et af mange, der udgør de skællede rødviolette krystaller af CrCl.3 (forveksl ikke krystalfarven, sandt, med farven på de grønne kugler).
Som det kan ses, er anionerne Cl- de optager overfladen, så deres negative ladninger afviser de andre krystallinske lag. Derfor bliver krystallerne flakke og sprøde; men skinnende på grund af krom.
Hvis de samme lag visualiseres fra et lateralt perspektiv, vil det blive observeret i stedet for oktaeder, forvrænget tetraeder:
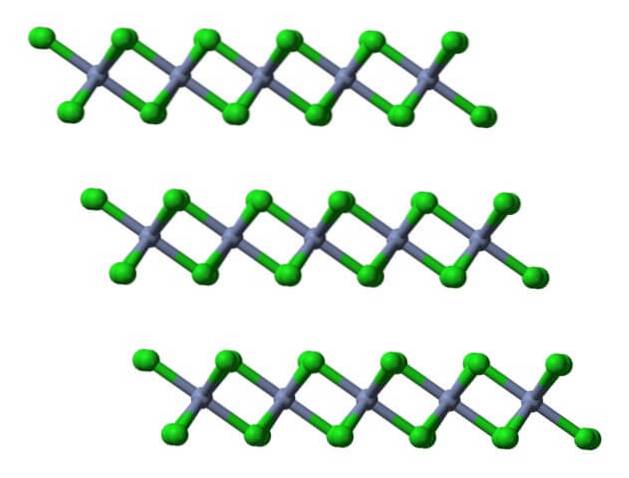
Her letter det yderligere forståelsen af, hvorfor lagene frastøder hinanden, når Cl-anioner binder.- af deres overflader.
Ejendomme
Navne
-Chrom (III) chlorid
-Chrom (III) trichlorid
-Vandfri chrom (III) chlorid.
Kemisk formel
-CrCl3 (vandfri).
-CrCl3.6HtoO (hexahydrat).
Molekylær vægt
-158,36 g / mol (vandfri).
-266,43 g / mol (hexahydrat).
Fysisk beskrivelse
-Rød-violette faste stoffer og krystaller (vandfri).
-Mørkegrønt krystallinsk pulver (hexahydrat, bundbillede). I dette hydrat kan det ses, hvordan vand hæmmer glans, en metallisk egenskab ved krom.

Smeltepunkt
-1.152 ºC (2.106 ºF, 1.425 K) (vandfri)
-83 ºC (hexahydrat).
Kogepunkt
1300 ºC (2.370 ºF, 1.570) (vandfri).
Vandopløselighed
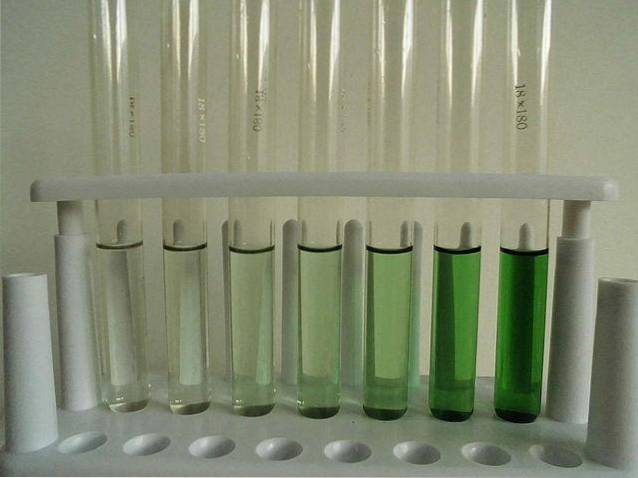
-Let opløselig (vandfri).
-585 g / L (hexahydrat).
Billedet ovenfor viser en række reagensglas fyldt med en vandig opløsning af CrCl3. Bemærk, at jo mere koncentreret det er, jo mere intens farven på komplekset [Cr (OHto)6]3+, ansvarlig for den grønne farve.
Opløselighed i organiske opløsningsmidler
Opløselig i ethanol, men uopløselig i ether (vandfri).
Massefylde
-2,87 gr / cm3 (vandfri).
-2,76 g / cm3 (hexahydrat).
Stuetemperatur
Nedbrydning
Ved opvarmning til nedbrydning udsender chrom (III) chlorid giftige dampe af klorholdige forbindelser. Disse forbindelser frigøres også, når chrom (III) chlorid kommer i kontakt med stærke syrer..
Korrosion
Det er meget ætsende og kan angribe visse stål.
Reaktioner
Det er uforeneligt med stærke oxidanter. Det reagerer også stærkt med lithium og nitrogen..
Når det opvarmes i nærværelse af hydrogen, reduceres det til chrom (II) chlorid med dannelsen af hydrogenchlorid.
2 CrCl3 + Hto => 2 CrClto + 2 HCI
pH
I en vandig opløsning og med en koncentration på 0,2 M: 2,4.
Syntese
Chrom (III) chloridhexahydrat produceres ved at reagere chromhydroxid med saltsyre og vand.
Cr (OH)3 + 3 HCI + 3 HtoO => CrCl3.6HtoELLER
Derefter opvarmes CrCl for at opnå det vandfrie salt3.6HtoEller i nærværelse af thionylchlorid, SOClto, saltsyre og varme:
[Cr (HtoELLER)6Cl3 + 6SOClto + ∆ → CrCl3 + 12 HCI + 6SOto
Alternativt kan CrCl3 opnået ved at føre klorgas over en blanding af chrom og carbonoxid.
CrtoELLER3 + 3 C + Clto => 2 CrCl3 + 3 CO
Og endelig, da det er den mest anvendte metode, er det at opvarme dets oxid med et halogeneringsmiddel, såsom carbontetrachlorid:
CrtoELLER3 + 3CCl4 + ∆ → 2CrCl3 + 3COClto
Ansøgninger
Industriel
Chromchlorid er involveret i in situ-fremstilling af chrom (II) chlorid; reagens involveret i reduktionen af alkylhalogenider og i syntesen af (E) -alkenylhalogenider.
-Det bruges i forkromningsteknikken. Dette består i deponering ved hjælp af galvanisering af et tyndt lag krom på metalgenstande eller andet materiale med et dekorativt mål, hvilket øger modstandsdygtigheden over for korrosion og også overfladehårdheden..
-Det bruges som en tekstil mordant, der tjener som et link mellem farvningsmaterialet og de stoffer, der skal farves. Derudover anvendes det som en katalysator til produktion af olefiner og vandtætningsmidler..
Terapeutik
Brug af USP chromchloridtilskud anbefales til patienter, der kun får intravenøse opløsninger, administreret til total parenteral ernæring (TPN). Derfor kun når disse patienter ikke modtager alle deres ernæringsmæssige behov.
Krom (III) er en del af glukosetoleransfaktoren, en aktivator af insulinfremmende reaktioner. Chrom (III) menes at aktivere metabolisme af glukose, protein og lipider, hvilket letter virkningen af insulin hos mennesker og dyr.
Krom er til stede i mange fødevarer. Men koncentrationen overstiger ikke 2 pr. Portion, idet broccoli er den mad, der har det højeste bidrag (11 µg). Derudover er tarmabsorptionen af krom lav med en værdi på 0,4 til 2,5% af den indtagne mængde..
Dette gør det vanskeligt at etablere en diæt til levering af krom. I 1989 anbefalede National Academy of Sciences 50 til 200 µg / dag som et passende indtag af krom..
Risici
Blandt de mulige risici ved at indtage dette salt som kromstilskud er:
-Alvorlige mavesmerter.
-Unormal blødning, som kan variere fra vanskeligheder med at helbrede et sår, rødmer blå mærker eller mørkning af afføringen fra indre blødninger.
-Irritationer i fordøjelsessystemet, der forårsager sår i maven eller tarmene.
-Dermatitis
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Wikipedia. (2019). Chrom (III) chlorid. Gendannet fra: en.wikipedia.org
- Chrom (III) chlorid [PDF]. Gendannet fra: alpha.chem.umb.edu
- PubChem. (2019). Chromchloridhexahydrat. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- National Institutes of Health. (21. september 2018). Krom: Faktaark om kosttilskud. Gendannet fra: ods.od.nih.gov
- Tomlinson Carole A. (2019). Kromchlorid bivirkninger. Leaf Group Ltd. Gendannet fra: healthfully.com



Endnu ingen kommentarer