
Natriumchlorid (NaCl) struktur, egenskaber, anvendelser
Det natriumchlorid, Også kaldet almindeligt salt eller bordsalt, det er et binært uorganisk salt af alkalimetalnatrium og halogenchlor. Det er den største bestanddel af spiseligt salt, og dets mineralform er kendt som halit. Dens molekylformel er NaCl, og den beskriver det støkiometriske forhold mellem dets ioner (Na+ Cl-) og ikke et diskret molekyle (Na-Cl)
Natriumchlorid er et hvidt krystallinsk fast stof, der dannes ved kombinationen af natrium, et sølvhvidt metal, der reagerer voldsomt med vand, og elementet klor, en giftig, ætsende og lysegrøn gas..

En del af NaCl-krystaller er vist i det øverste billede. Hvordan er det muligt, at to elementer så farlige som Na og Clto, kan der dannes et spiseligt salt? For det første er den kemiske ligning for dets dannelse:
2Na (s) + Clto(g) => 2NaCl (s)
Svaret ligger i arten af bindingen i NaCl. At være ionisk, egenskaberne af Na+ og Cl- er diagonalt forskellige fra deres neutrale atomer.
Natrium er et vitalt element, men i sin ioniske form. Na+ er den vigtigste ekstracellulære kation med en koncentration på ca. 140 mEq / l, og sammen med dens ledsagende anioner er Cl- og HCO3- (bicarbonat), er hovedsagelig ansvarlige for værdien af osmolaritet og ekstracellulært volumen.
Desuden er Na+ det er ansvarligt for dannelsen og ledningen af nerveimpulsen i de neuronale axoner såvel som for initiering af muskelsammentrækning.
NaCl er siden oldtiden blevet brugt til at smage mad og konservere kød på grund af dets evne til at dræbe bakterier og forhindre ødelæggelse.
Det er også nødvendigt til produktion af natriumhydroxid (NaOH) og molekylær chlor (Cltoved omsætning af NaCl med vand under hydrolyse:
2HtoO (l) + 2 NaCl (s) => 2NaOH (aq) + Clto(g) + Hto(g)
I katoden (-) akkumuleres Hto (g) og NaOH. I mellemtiden akkumuleres Cl i anoden (+)to (g). Natriumhydroxid anvendes til fremstilling af sæber og klor til fremstilling af PVC-plast.
Artikelindeks
- 1 Struktur af natriumchlorid
- 1.1 Enhedscelle
- 2 egenskaber
- 2.1 Molekylær formel
- 2.2 Molekylvægt
- 2.3 Fysisk beskrivelse
- 2.4 Farve
- 2.5 Smag
- 2.6 Kogepunkt
- 2.7 Smeltepunkt
- 2.8 Opløselighed i vand
- 2.9 Opløselighed i organiske opløsningsmidler
- 2.10 Tæthed
- 2.11 Damptryk
- 2.12 Stabilitet
- 2.13 Nedbrydning
- 2.14 Viskositet
- 2.15 Korrosion
- 2,16 pH
- 3 anvendelser
- 3.1 I mad
- 3.2 Industrielle anvendelser
- 3.3 Hjemme
- 3.4 Andre anvendelser
- 3.5 Terapeutiske anvendelser
- 4 Toksicitet
- 4.1 Indtagelse
- 4.2 Irritation og fysisk kontakt
- 5 Referencer
Struktur af natriumchlorid
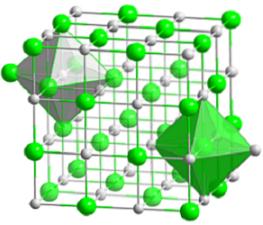
Det øverste billede repræsenterer den kompakte kubiske struktur af natriumchlorid. De voluminøse grønne kugler svarer til Cl-anionerne-, mens de hvide, til Na-kationerne+. Bemærk, hvordan NaCl-krystallen består af et netværk af ioner arrangeret af deres elektrostatiske interaktioner i forholdet 1: 1..
Selvom bjælker er vist på billedet, er bindingerne ikke kovalente, men ioniske. Anvendelsen af søjler er nyttig, når koordinationsgeometrien omkring en ion vises. For eksempel i tilfælde af NaCl hver Na+ er omgivet af seks Cl- (hvid oktaeder) og hver Cl- af seks Na+ (grøn oktaeder).
Derfor har den en koordination (6,6), hvis antal indikerer, hvor mange naboer der omgiver hver ion. Tallet til højre angiver naboer til Na+, mens den til venstre, Cl-.
Andre repræsentationer udelader brugen af søjler til at fremhæve de oktaedriske huller i strukturen, som skyldes det mellemliggende mellemrum mellem seks Cl-anioner.- (eller Na-kationer+) pakket. Dette arrangement observeres i andre mono (MX) eller polyatomiske uorganiske salte og kaldes perlesaltet.
Enhedscelle
Enhedscellen af stensalt er kubisk, men hvilke terninger repræsenterer den nøjagtigt i billedet ovenfor? Oktahederne giver svaret. Begge dækker en samlet celle, der består af fire små terninger.
Disse terninger har dele af ionerne ved deres hjørner, kanter og ansigter. Ser man tæt på, en Na-ion+ den er placeret i midten og tolv af dem på kanterne. En ion på en kant kan deles med fire terninger. Så der er 4 Na-ioner+ (12 × 1/4 + 1 = 4).
For Cl-ioner-, otte er placeret ved hjørnerne og seks ved kanterne. Da ionerne placeret i hjørnerne deler plads med otte andre terninger, og i kanterne med seks har vi 4 Cl-ioner- (8 × 1/8 + 6 × 1/2 = 4).
Ovenstående resultat fortolkes som følger: i enhedscellen af NaCl er der fire Na-kationer+ og fire Cl-anioner-; andel, der stemmer overens med den kemiske formel (a Na+ for hver Cl-).
Ejendomme
Molekylær formel
NaCl.
Molekylær vægt
58,44 g / mol.
Fysisk beskrivelse
Et krystallinsk fast stof.
Farve
Transparente farveløse krystaller eller hvidt krystallinsk pulver.
Smag
Saltet.
Kogepunkt
2.575ºF til 760 mmHg.
1.465 ºC.
Smeltepunkt
1.474 ºF (800,7 ºC).
Både kogepunktet og smeltepunktet afspejler den varme, der er nødvendig for at overvinde den krystallinske gitterenergi. Derfor bekræfter disse målinger den ioniske karakter af NaCl..
Vandopløselighed
Større end eller lig med 100 mg / ml ved 68ºF.
36,0 g / 100 ml ved 25 ° C.
Det er faktisk et hygroskopisk salt, der bevarer fugt fra miljøet.
Opløselighed i organiske opløsningsmidler
0,065 g / 100 ml ethanol ved 25 ° C; 10 g / 100 g glycerol ved 25 ° C; 2,15 g / 100 ml flydende ammoniak ved 40 ° C; 1,4 g / 100 ml methanol ved 25 ° C; 7,15 g / 100 ethylenglycol ved 25 ° C og 5,21 g / 100 g myresyre ved 25 ° C.
Massefylde
2,165 g / cm3 ved 77 ºC.
Damptryk
1 mmHg ved 1.589ºF.
Stabilitet
Stabil under anbefalede opbevaringsforhold.
Nedbrydning
Når det opvarmes til høje temperaturer, nedbrydes det og udsender saltsyre og dinatriumoxiddampe..
Viskositet
Mættede opløsnings viskositet 1,93 mPa-s.
Korrosion
Det er ætsende for mange metaller.
pH
6,7 til 7,3 i vandig opløsning.
Ansøgninger
I mad
-Natriumchlorid har været brugt siden oldtiden til at forbedre smagen af mad og bevare den. Saltning af kød er en måde at beskytte det mod bakteriel handling, da det forsinker nedbrydning af protein.
-På den anden side øger salt osmolariteten omkring kødet, hvilket forårsager optagelse af osmose af bakteriens vand og forårsager eliminering.
Industrielle anvendelser
Fødevareindustri
-I fødevareindustrien anvendes salt som en smagsforstærker, gæringskontroladditiv, teksturkontrolmiddel og farveudvikler. For eksempel tilsættes salt for at fremhæve farven i bacon, skinke og andre kødprodukter..
-Salt tjener som bindemiddel til fremstilling af pølser. Bidrager til dannelsen af en bindemiddelgel bestående af kød, fedt og fugt.
-Ved melforarbejdning til brødfremstilling tilsættes salt under bagning for at kontrollere hastigheden af hævning af brøddejen. Det bruges også til at styrke gluten og som smagsforstærker samt fyldning i bagværk.
-Det bruges til fremstilling af morgenmadsprodukter, blandede eller tilberedte mel, pommes frites, hunde- og kattefoder osv..
Syntese af kemikalier
-Natriumchlorid bruges som råmateriale til produktion af natriumhydroxid og klor, hvilket igen er nyttigt i mange kemiske industrier.
-Salt bruges til forarbejdning af forskellige metaller, for eksempel aluminium, kobber, stål og vanadium. Det bruges også til at fremstille natriumchlorat, som senere bruges til syntesen af chlordioxid, en iltbaseret blegemiddel. Chlordioxid er mindre skadelig for miljøet end andre blegemidler.
I læderindustrien
-Saltet bruges til at hæmme den bakterielle virkning inde i huden såvel som til at hjælpe med dets rehydrering.
I tekstilindustrien
-Salt bruges som mordant ved farvning af stoffer. Det bruges som saltvandskylning for at fjerne organiske forurenende stoffer og skabe en positiv ladning på overfladen af tekstiler, der muliggør binding af negativt ladede farvestoffer..
I olieindustrien
-I olie- og gasefterforskning er salt en vigtig komponent i brøndborevæsker. Det bruges til at flokkulere og øge tætheden af borevæsker, hvilket gør det muligt at overvinde det høje gastryk i brøndene, der skal nås. Derudover opretholder saltet mætningen af borevæsken.
-Salt hjælper med at komprimere jorden, som veje er bygget på. Reducerer forskydning under jorden forårsaget af luftfugtighedsændringer og biltrafik.
I hjemmet
Salt er blevet brugt ved at gnide i rengøringsoverflader, gryder og pander. Også til forebyggelse af skimmelsvamp og som pletfjerner. Det bruges også i mange mærker af shampoo og tandpasta..
Andre anvendelser
På vejene
-I forventning om snefald er vejene dækket af saltlage, hvilket forhindrer is i at binde sig til vejoverfladen. Til optøning anvendes en blanding af saltvand og salt, og nogle gange tilsættes andre kemiske komponenter såsom magnesium eller calciumchlorid. Anvendelsen af salt og saltvand er ikke effektiv ved temperaturer under -10 ºC.
Tilsætning af salt producerer et fald i det kryoskopiske punkt, en kolligativ egenskab ved opløsningerne, hvilket hindrer dannelsen af is på en bestemt måde..
-På grund af sin hygroskopiske tilstand bruges salt som et billigt tørremiddel.
I harpikser, der bruges til at blødgøre vand
Hårdt vand indeholder calcium- og magnesiumioner, der forhindrer sæbens virkning og forårsager aflejringer af alkaliske materialer på forskellige udstyr og rør. I blødgøring af vand anvendes ionbytterharpikser. Salt bruges til fremstilling og regenerering af harpikser.
I ildslukkere
Natriumchlorid bruges i ildslukkere til at bekæmpe brande, hvor der er brændbare metaller, såsom magnesium-, kalium-, natrium- og NK-legeringer..
Salt fungerer som en kølelegeme og danner også en skorpe, der begrænser iltadgangen til ilden..
I brillerne
Natriumchloridkrystaller bruges i optiske komponenter såsom vinduer og prismer, især til infrarødt lys. Men da saltet er meget hygroskopisk, dannes der en slags frost, der dækker linserne. Af denne grund er natriumchloridlinser blevet erstattet af zinkselenid (ZnSe) linser..
Terapeutiske anvendelser
Fyld op for manglen på salte i kroppen
-Når der er en kropslig udtømning af Na+, skal udskiftes for at opretholde ekstracellulær osmolaritet, nerveledning og muskelsammentrækning.
-NaCl anvendes til behandling og forebyggelse af mangel på natrium og klor som følge af overdreven svedtendens under udsættelse for høje temperaturer. Det bruges også i en overdreven diurese eller en overdreven begrænsning af saltindtag.
-Parenteral levering af en 045% NaCl-opløsning anvendes til behandling af hyperosmolar diabetes. Det opfylder en rehydratiserende funktion og tjener til at vurdere status for nyrefunktionen.
-Injektioner af hypertoniske opløsninger med en NaCl-koncentration større end 0,9% w / v,
-De bruges, når der er en alvorlig Na-udtømning+, være en genopretning af den essentielle ion. Denne hyponatræmi kan være en konsekvens af en behandling med frie elektrolytter eller med en koncentration af Na+.
Hyponatræmi kan også være forårsaget af overdreven vandindtagelse, ikke kontrolleret af utilstrækkelig nyrefunktion..
I ukonventionelle behandlinger og anvendelser
-NaCl-inhalationsopløsninger bruges til at fortynde de lægemidler, der anvendes under forstøvningsprocessen. Det bruges også til trakealskylning og kunstvanding. 0,9% saltvand, der anvendes i næsespray.
-20% NaCl-opløsninger bruges til intra-amniotisk transabdominal installation, hvorved der induceres en sen abort i anden trimester af graviditeten..
-Natriumchlorid kan bruges som et lokalt antiseptisk middel. Takket være sin osmotiske kapacitet er den i stand til at dehydrere et bredt spektrum af vira og bakterier i en ikke-ansporet tilstand; derfor bruges det som et smertefuldt antiseptisk middel til at desinficere sår.
Toksicitet
Indtagelse
Det har kun en skadelig virkning på helbredet, hvis indtagelsen er høj og i lang tid. Under disse omstændigheder ville hypernatræmi forekomme med den deraf følgende stigning i ekstracellulært volumen, der ville føre til arteriel hypertension..
Irritation og fysisk kontakt
Det har kun en toksisk virkning, hvis inhalationen er meget høj. Overdreven kontakt med huden kan få den til at være tør. Endelig forårsager det en øjeblikkelig irritation ved kontakt med øjnene.
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave., S. 84, 90, 93, 263). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. Kemi. (8. udgave). CENGAGE Learning, s 482-483.
- Natriumchlorid. (2018). Sodium Chloride: Fordele, anvendelser, egenskaber, risici. Hentet fra: natriumchlorid.org
- PubChem. (2018). Natriumchlorid. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Natriumchlorid. Hentet fra: en.wikipedia.org
- Amerikanske elementer. (2018). Natriumchlorid. Hentet fra: americanelements.com



Endnu ingen kommentarer