
Kvartære forbindelsers egenskaber, dannelse, eksempler
Det kvaternære forbindelser De er alle dem, der har fire forskellige atomer eller ioner. Derfor kan de være molekylære eller ioniske arter. Deres mangfoldighed inkluderer både organisk og uorganisk kemi, der er en meget voluminøs gruppe; skønt måske ikke så meget sammenlignet med binære eller ternære forbindelser.
Årsagen til, at antallet er mindre, er fordi de fire atomer eller ioner skal holdes sammen af deres kemiske affiniteter. Ikke alle elementerne er kompatible med hinanden og endnu mindre, når en kvartet overvejes; pludselig er et par af dem mere beslægtede med hinanden end med det andet par.
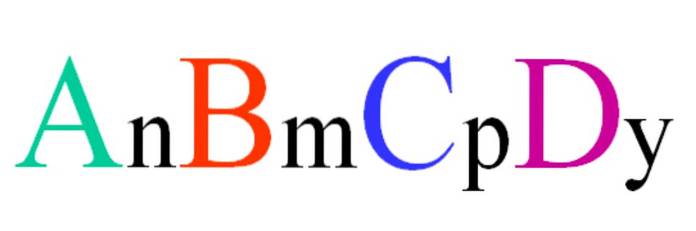
Overvej en kvaternær forbindelse med den tilfældige formel ABCD. Abonnementerne n, m, p og y er de støkiometriske koefficienter, som igen indikerer, hvor stor andel af hvert atom der er i forhold til de andre..
Således er formlen AnBmCsDY det vil være gyldigt, hvis det overholder elektronisk neutralitet. Endvidere vil en sådan forbindelse være mulig, hvis dens fire atomer er tilstrækkeligt beslægtede med hinanden. Det ses, at denne formel ikke gælder for mange forbindelser, men især legeringer eller mineraler..
Artikelindeks
- 1 Karakteristika for kvaternære forbindelser
- 1.1 Kemi
- 1.2 Fysisk
- 2 Nomenklatur
- 2.1 Sur oxisales
- 2.2 Grundlæggende oxisales
- 2.3 Dobbelt salte
- 2.4 Hydrerede salte
- 3 Træning
- 4 eksempler
- 5 Referencer
Karakteristika for kvaternære forbindelser
Kemisk
En kvaternær forbindelse kan være ionisk eller kovalent og udvise de forventede egenskaber for dens natur. Joniske ABCD-forbindelser forventes at være opløselige i vand, alkoholer eller andre polære opløsningsmidler; de skal have høje kogepunkter og smeltepunkter og være gode ledere af elektricitet, når de smeltes.
Med hensyn til de kovalente ABCD-forbindelser består de fleste af nitrogenholdige, iltede eller halogenerede organiske forbindelser; det vil sige, at dens formel ville blive CnHmELLERsNY eller CnHmELLERsxY, hvor X er et halogenatom. Af disse molekyler ville det være logisk at tro, at de var polære i betragtning af de høje elektronegativiteter af O, N og X.
En rent kovalent ABCD-forbindelse kan have mange bindingsmuligheder: A-B, BC, D-A osv., Naturligvis afhængigt af atomernes affiniteter og elektroniske kapacitet. Mens en ren ionisk ABCD-forbindelse er dens interaktioner elektrostatiske: A+B-C+D-, for eksempel.
I tilfælde af en legering, der betragtes som mere en fast blanding end en forbindelse korrekt, ABCD består af neutrale atomer i jordtilstande (i teorien).
Af resten kan en ABCD-forbindelse være neutral, sur eller basisk, afhængigt af dens atoms identitet..
Fysisk
Fysisk set er det sandsynligt, at ABCD ikke bliver en gas, da fire forskellige atomer altid indebærer en højere molekylmasse eller formel. Hvis det ikke er en væske med et højt kogepunkt, kan det forventes, at det er et fast stof, hvis nedbrydning skal generere mange produkter.
Igen vil deres farver, lugt, struktur, krystaller osv. Være underlagt hvordan A, B, C og D eksisterer sammen i forbindelsen og vil afhænge af deres synergi og strukturer..
Nomenklatur
Indtil videre er spørgsmålet om kvaternære forbindelser blevet behandlet på en global og upræcis måde. Bortset fra organisk kemi (amider, benzylchlorider, kvaternære ammoniumsalte osv.) Er der i uorganisk kemi veldefinerede eksempler kaldet sure og basiske oxysalte..
Syre oxisales
Syreoxysalte er dem, der stammer fra den delvise neutralisering af en polyprotisk oxosyre. Således erstattes et eller flere af dets hydrogener med metalkationer, og jo færre resterende hydrogener det har, jo mindre surt vil det være..
F.eks. Fra phosphorsyre, H3PO4, Op til to syresalte af f.eks. Natrium kan opnås. Disse er: NaHtoPO4 (Na+ erstatter et hydrogen svarende til H+) og NatoHPO4.
Ifølge den traditionelle nomenklatur er disse salte navngivet på samme måde som oxysalt (helt deprotoneret), men med ordet 'syre' forud for navnet på metallet. Således NaHtoPO4 ville være natriumsyrephosphat og NatoHPO4 natriumsyrephosphat (fordi det har et H tilbage).
På den anden side foretrækker stamnomenklaturen at bruge ordet 'brint' end 'syre'. NaHtoPO4 ville derefter blive natriumdihydrogenphosphat og NatoHPO4 natriumhydrogenphosphat. Bemærk, at disse salte har fire atomer: Na, H, P og O.
Grundlæggende oxisales
De grundlæggende oxysalte er dem, der indeholder OH-anionen i deres sammensætning-. Overvej for eksempel saltet CaNO3OH (Ca.to+ IKKE3- Åh-). For at navngive det ville det være nok at gå foran ordet 'grundlæggende' til navnet på metallet. Således ville dets navn være: basisk calciumnitrat. Og hvad med CuIO?3OH? Dets navn ville være: cupric basic iodate (Cuto+ IO3- Åh-).
Ifølge stamnomenklaturen erstattes ordet 'grundlæggende' med hydroxid efterfulgt af brug af en bindestreg før navnet på oxoanion.
Efter gentagelse af de foregående eksempler ville deres navne være for hver enkelt: Calciumhydroxid-nitrat og kobber (II) hydroxid-iodat; huske på, at metalets valens skal angives i parentes og med romertal.
Dobbelt salte
I dobbeltsalte er der to forskellige kationer, der interagerer med den samme type anion. Antag dobbelt salt: Cu3Tro (PO4)3 (Cuto+ Tro3+ PO43-). Det er et fosfat af jern og kobber, men det mest passende navn at henvise til dette er: tredobbelt fosfat af kobber (II) og jern (III).
Hydrerede salte
Disse er hydrater, og den eneste forskel er, at antallet af vand, der skal formuleres, er specificeret i slutningen af deres navne. For eksempel MnClto er mangan (II) chlorid.
Dens hydrat, MnClto4HtoEller det kaldes mangan (II) chloridtetrahydrat. Bemærk, at der er fire forskellige atomer: Mn, Cl, H og O.
Et berømt dobbelthydreret salt er Mohr's, Fe (NH4)to(SW4)to6HtoO. Dens navn er: dobbelt jern (II) sulfat og ammoniumhexahydrat.
Uddannelse
Igen med fokus på uorganiske kvaternære forbindelser ser det ud til, at de for det meste er produktet af delvise neutraliseringer. Hvis disse forekommer i nærværelse af flere metaloxider, er det sandsynligt, at der opstår dobbelt salte; og hvis mediet er meget basisk, udfældes de basiske oxysalte.
Og hvis vandmolekylerne på den anden side har en affinitet for metallet, vil de koordinere direkte med det eller med ionerne, der omgiver det og danner hydraterne.
På legeringssiden skal der svejses fire forskellige metaller eller metalloider for at skabe kondensatorer, halvledere eller transistorer..
Eksempler
Endelig vises en liste med forskellige eksempler på kvaternære forbindelser nedenfor. Læseren kan bruge den til at teste deres viden om nomenklatur:
- PbCO3(OH)to
- Cr (HSO4)3
- NaHCO3
- ZnIOH
- Cuto(OH)toSW3
- LitoKAsO4
- RUTE45HtoELLER
- AgAu (SO4)to
- Sag42HtoELLER
- FeCl36HtoELLER
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Nomenklatur og uorganisk formulering. [PDF]. Gendannet fra: recursostic.educacion.es
- Erika Thalîa Godt. (2019). Dobbelt salte. Akademi. Gendannet fra: academia.edu
- Wikipedia. (2019). Kvartær ammoniumkation. Gendannet fra: en.wikipedia.org



Endnu ingen kommentarer