
Galvaniske korrosionsmekanismer, eksempler, beskyttelse
Det galvanisk eller elektrokemisk korrosion Det er en proces, hvor et metal eller legering nedbrydes hurtigere sammenlignet med dets konventionelle oxidation. Det kan siges, at det er en accelereret oxidation og endog med vilje formildet; som det sker i celler eller batterier.
Dette finder sted under en række betingelser. Først skal der være et aktivt metal, kaldet anoden. Også, og for det andet skal der være et ædle metaller med lav reaktivitet kaldet katoden. Den tredje og fjerde tilstand er tilstedeværelsen af et medium, hvor elektroner formerer sig, såsom vand, og ioniske arter eller elektrolytter..

Galvanisk korrosion kan observeres, især i havmiljøer eller ved strande. Luftstrømme hæver masser af vanddamp, som igen fører nogle ioner; sidstnævnte ender med at klæbe til et tyndt lag vand eller dråber, der hviler på metaloverfladen.
Disse fugtigheds- og saltholdighedsforhold favoriserer metalets korrosion. Det vil sige, at en jernkrone som den på billedet ovenfor vil ruste hurtigere, hvis den udsættes for havet..
Den lethed, som et metal skal oxideres i forhold til et andet, kan måles kvantitativt gennem dets reduktionspotentialer; kemibøger bugner af tabeller med disse potentialer E. Jo mere negativ det er, jo større er dets tilbøjelighed til at ruste.
Ligeledes, hvis dette metal er i nærværelse af et andet med et meget positivt reduktionspotentiale og således har et stort AE, vil oxidationen af det reaktive metal være mere aggressivt. Andre faktorer, såsom pH, ionstyrke, fugtighed, tilstedeværelsen af ilt og forholdet mellem de områder af metallet, der oxideres, og at det reduceres, er også vigtige..
Artikelindeks
- 1 Mekanismer
- 1.1 Begreber og reaktioner
- 1.2 Afpolarisatorer
- 1.3 Jernkorrosion
- 2 Eksempler
- 2.1 Anodiske indekser
- 3 Beskyttelse mod elektrokemisk korrosion
- 3.1 Offerbelægninger
- 3.2 Ædle belægninger
- 4 Eksperiment for børn
- 4.1 Jernplade i opløsning af kobbersalte
- 4.2 Rengøring af sølvoxid
- 5 Referencer
Mekanismer
Begreber og reaktioner
Inden man tager fat på mekanismerne bag galvanisk korrosion, bør visse begreber afklares.
I en redox-reaktion mister en art elektroner (oxiderer), mens en anden vinder dem (reducerer). Elektroden, hvorpå oxidation opstår, kaldes anoden; og hvorpå reduktionen sker, katode (på engelsk mnemonic rule redcat at huske).
Således for en elektrode (et stykke, skrue osv.) Af et metal M, hvis det oxiderer siges det at være anoden:
M => Mn+ + ne-
Antallet af frigivne elektroner vil være lig med størrelsen af den positive ladning af kationen Mn+ resulterer.
Derefter modtager en anden elektrode eller metal R (begge metaller skal være i kontakt på en eller anden måde), de frigivne elektroner; men dette gennemgår ikke en kemisk reaktion, hvis det får elektroner, da det kun vil lede dem (elektrisk strøm).
Derfor skal der være en anden art i opløsning, der formelt kan acceptere disse elektroner; som let reducerede metalioner, for eksempel:
Rn+ + ne- => R
Det vil sige, at der dannes et lag af metal R, og elektroden bliver derfor tungere; mens metallet M ville miste masse på grund af dets atomer opløst.
Afpolarisatorer
Hvad hvis der ikke var nogen metalkationer, der kunne reduceres let nok? I så fald vil andre arter, der er til stede i mediet, tage elektronerne: depolarisatorerne. Disse er tæt knyttet til pH: Oto, H+, Åh- og HtoELLER.
Ilt og vand vinder elektroner i en reaktion udtrykt ved følgende kemiske ligning:
ELLERto + 2HtoO + 4e- => 4OH-
Mens H-ionerne+ omdanne til Hto:
2H+ + 2e- => Hto
Det vil sige arten OH- og Hto er almindelige produkter af galvanisk eller elektrokemisk korrosion.
Selvom metallet R ikke deltager i nogen reaktion, fremmer det faktum, at det er mere ædelt end M dets oxidation; og følgelig vil der være en højere produktion af OH-ioner- eller brintgas. Fordi det trods alt er forskellen mellem reduktionspotentialerne, AE, en af de vigtigste drivkræfter for disse processer.
Jernkorrosion
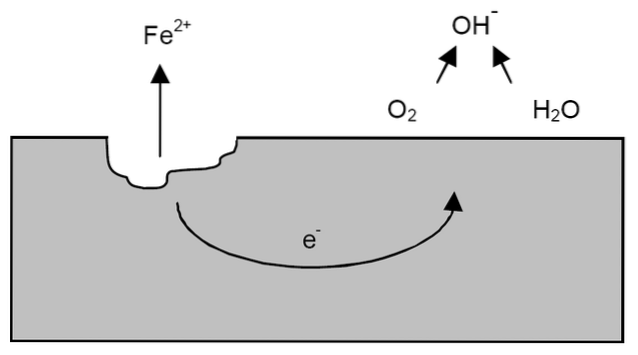
Efter de tidligere afklaringer kan eksemplet på jernkorrosion løses (øverste billede). Antag at der er et tyndt lag vand, hvor ilt opløses. Uden tilstedeværelsen af andre metaller vil det være depolarisatorerne, der vil sætte retningslinjerne for reaktionen.
Således vil jern miste nogle atomer fra overfladen for at opløses i vand som Fe kationer.to+:
Tro => Troto+ + 2e-
De to elektroner bevæger sig gennem jernstykket, fordi det er en god leder af elektricitet. Så hvor oxidationen eller anodestedet startede er kendt; men ikke hvor reduktionen vil fortsætte eller placeringen af det katodiske sted. Katodestedet kan være hvor som helst; og jo større dets mulige areal er, desto værre korroderer metallet.
Antag, at elektronerne når et punkt som vist på billedet ovenfor. Der gennemgår både ilt og vand den allerede beskrevne reaktion, hvorved OH frigøres-. Disse OH-anioner- kan reagere med Feto+ til dannelse af Fe (OH)to, som udfælder og gennemgår efterfølgende oxidationer, der til sidst omdanner det til rust.
I mellemtiden knækker anodesiden mere og mere.
Eksempler
I hverdagen er eksemplerne på galvanisk korrosion mange. Vi behøver ikke henvise til jernkronen: enhver artefakt lavet af metaller kan gennemgå den samme proces i nærværelse af fugtige og salte omgivelser.
Foruden stranden kan vinteren også give ideelle betingelser for korrosion; for eksempel når man skubber salte i sneen på vejen for at forhindre biler i at glide.
Fra det fysiske synspunkt kan fugt tilbageholdes i de svejsede samlinger af to metaller, der er aktive steder for korrosion. Dette skyldes, at begge metaller opfører sig som to elektroder, og jo mere reaktivt man mister sine elektroner..
Hvis produktionen af OH-ioner- Det er betydeligt, det kan endda korrodere malingen på bilen eller den pågældende enhed.
Anodiske indekser
Man kan bygge sine egne eksempler på galvanisk korrosion ved hjælp af reduktionspotentialetabellerne. Imidlertid vil den anodiske indekstabel (i sig selv forenklet) blive valgt for at illustrere dette punkt..
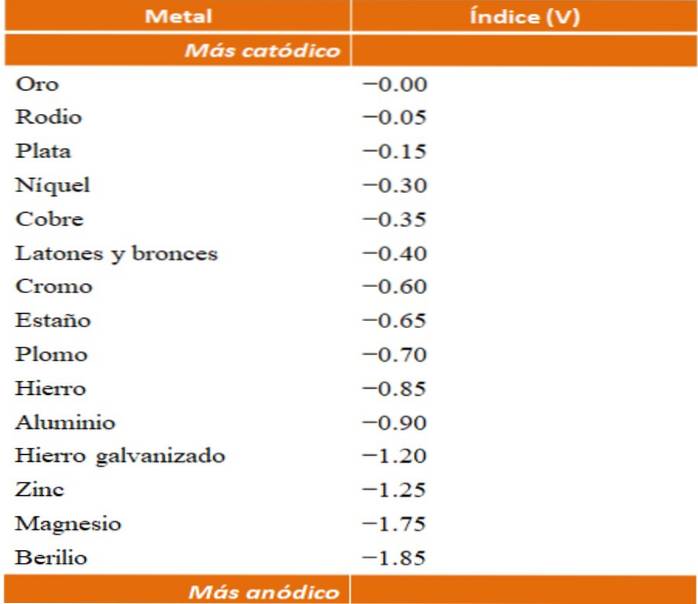
Antag for eksempel, at vi ville bygge en elektrokemisk celle. Metallerne, der er øverst i tabellen med anodiske indekser, er mere katodiske; det vil sige, de reduceres let, og det vil derfor være vanskeligt at have dem i løsning. Mens metallerne i bunden er mere anodiske eller reaktive, og de korroderer let.
Hvis vi vælger guld og beryllium, kunne begge metaller ikke være sammen længe, da beryllium oxiderede ekstremt hurtigt..
Og hvis vi derimod har en løsning af Ag-ioner+ og vi fordyber en aluminiumstang i den, dette vil opløses på samme tid, som metalliske sølvpartikler udfældes. Hvis denne bjælke var forbundet med en grafitelektrode, ville elektroner rejse til den for at elektrokemisk deponere sølv på den som en sølvfilm..
Og hvis den i stedet for aluminiumsstangen var lavet af kobber, ville løsningen blive blålig på grund af tilstedeværelsen af Cu-ioner.to+ i vand.
Elektrokemisk korrosionsbeskyttelse
Offerbelægninger
Antag at du vil beskytte et zinkark mod korrosion i nærvær af andre metaller. Den enkleste mulighed ville være at tilføje magnesium, som ville belægge zinket, så når de er oxideret reducerer elektronerne frigivet fra magnesium Zn-kationerne.to+ tilbage.
Imidlertid ville MgO-filmen på zink ende med at revne hurtigere end senere og tilvejebringe anodesteder med høj strømtæthed; det vil sige, korrosionen af zink vil accelereere kraftigt lige på disse punkter.
Denne elektrokemiske korrosionsbeskyttelsesteknik er kendt som brugen af offerbelægninger. Den bedst kendte er zink, der bruges i den berømte teknik kaldet galvanisering. I dem er metal M, især jern, belagt med zink (Fe / Zn).
Igen oxiderer zinket, og dets oxid tjener til at dække jernet og transmittere elektroner til det, der reducerer Feto+ der kan dannes.
Ædle belægninger
Antag igen, at du vil beskytte det samme zinkark, men nu bruger du krom i stedet for magnesium. Krom er mere ædelt (mere katodisk, se tabel med anodiske indekser) end zink og fungerer derfor som en ædel belægning.
Problemet med denne type belægning er, at når den først revner, vil den yderligere fremme og fremskynde oxidationen af metallet nedenunder; i dette tilfælde korroderer zinken endnu mere end at være belagt med magnesium.
Og endelig er der andre belægninger, der består af maling, plast, antioxidanter, fedtstoffer, harpikser osv..
Eksperiment for børn
Jernplade i opløsning af kobbersalte
Et simpelt eksperiment kan udtages fra den samme tabel med anodeindekser. Opløsning af en rimelig mængde (mindre end 10 gram) CuSO45HtoEller i vand bliver et barn bedt om at dyppe ned i en poleret jernplade. Der tages et billede, og processen får lov til at udfolde sig i et par uger.
Opløsningen er oprindeligt blålig, men begynder at falme, mens jernpladen får en kobberfarve. Dette skyldes, at kobber er mere ædelt end jern, og derfor er dets kationer Cuto+ De vil blive reduceret til metallisk kobber fra ionerne givet ved oxidation af jern:
Tro => Troto+ + 2e-
Cuto+ + 2e- => Cu
Rengøring af sølvoxid
Sølvgenstande sorte over tid, især hvis de er i kontakt med en kilde til svovlforbindelser. Dens rust kan fjernes ved at nedsænke objektet i et kar med vand med bagepulver og aluminiumsfolie. Bicarbonatet tilvejebringer de elektrolytter, der letter transporten af elektroner mellem objektet og aluminiumet.
Som et resultat vil barnet forstå, at objektet mister sine sorte pletter og vil lyse med sin karakteristiske sølvfarve; mens aluminiumsfolien korroderer for at forsvinde.
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Wikipedia. (2019). Galvanisk korrosion. Gendannet fra: en.wikipedia.org
- Stephen Lower. (16. juni 2019). Elektrokemisk korrosion. Kemi LibreTexts. Gendannet fra: chem.libretexts.org
- Det åbne universitet. (2018). 2.4 Korrosionsprocesser: galvanisk korrosion. Gendannet fra: open.edu
- Kundens tekniske servicebørste Wellman Inc. (s.f.). En guide til galvanisk korrosion. Børste Wellman Engineered Materials.
- Giorgio Carboni. (1998). Eksperimenter inden for elektrokemi. Gendannet fra: funsci.com



Endnu ingen kommentarer