
Bowmans kapselstruktur, histologi, funktioner

Det Bowmans kapsel repræsenterer det indledende segment af den rørformede komponent i nefronen, den anatomisk-funktionelle enhed af nyren, hvor processerne til produktion af urin udføres, og med hvilken nyren bidrager til bevarelsen af organismenes homeostase.
Det blev navngivet til ære for den engelske øjenlæge og anatom Sir William Bowman, der opdagede dets eksistens og offentliggjorde sin histologiske beskrivelse for første gang i 1842..
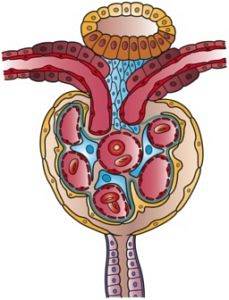
Der er en vis forvirring i litteraturen med hensyn til nomenklaturen for de første segmenter af nefronen, herunder Bowmans kapsel. Nogle gange beskrives det som en anden del af glomerulus og udgør med det nyrekroppen, mens det for andre fungerer som et medlem af glomerulus.
Uanset om kapslen i anatomiske beskrivelser er en del af eller er en del af glomerulus, er faktum, at begge elementer er så tæt forbundet i deres struktur og funktion, at udtrykket glomerulus vækker hos dem, der tænker over det, ideen om en lille kugle med dens skibe..
Ellers ville kapslen simpelthen være en beholder, i hvilken den filtrerede væske hældes i glomerulus, men den ville ikke have nogen del i selve den glomerulære filtreringsproces. Hvilket ikke er tilfældet, da det, som det ses, er en del af den proces, som det bidrager til på en særlig måde.
Artikelindeks
- 1 Struktur og histologi
- 2 funktioner
- 3 Bestemmelser af størrelsen af glomerulær filtrering
- 3.1 Filtreringskoefficient (Kf)
- 3.2 Effektivt filtreringstryk (Peff)
- 4 Filtreringsindeks (IF) for stoffer, der er til stede i plasma
- 5 Referencer
Struktur og histologi
Bowmans kapsel er som en lille kugle, hvis væg invaginerer i den vaskulære sektor. I denne invagination gennemtrænges kapslen af kapillærkuglen, som stammer fra den afferente arteriole og tilfører blod til glomerulus, hvorfra den efferente arteriole også kommer ud, som trækker blod fra glomerulus..
Den modsatte ende af kapslen, kaldet urinpolen, ser ud som om kuglens væg havde et hul, hvortil enden af det første segment, der initierer selve den rørformede funktion, er forbundet, det vil sige den proksimale krumme rør..
Denne ydre væg af kapslen er et fladt epitel og kaldes Bowmans kapsel parietale epitel. Ændringer i struktur ved overgang til proksimalt tubuliepitel ved urinpolen og visceralt epitel ved vaskulærpolen.
Det invaginerede epitel kaldes visceralt, fordi det omgiver de glomerulære kapillærer, som om de var en indvolde. Det er dannet af celler kaldet podocytter, der krammer, dækker dem, kapillærerne og har meget særlige egenskaber.
Podocytterne er organiseret i et enkelt lag, der udsender udvidelser, der interdigiterer med udvidelserne af nabopodocytterne, hvilket efterlader mellemrum mellem dem kaldet spalteporer eller filtreringsspalter, som er kontinuitetsløsninger til passage af filtratet..
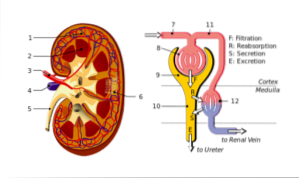
Podocytterne og de endotelceller, de dækker, syntetiserer en basalmembran, hvorpå de hviler, og som også har kontinuitetsløsninger til passage af vand og stoffer. Endotelceller er fenestreret og tillader også filtrering.
Så disse tre elementer: kapillært endotel, kældermembran og visceralt epitel i Bowmans kapsel udgør tilsammen membranen eller filtreringsbarrieren..
Funktioner
Kapslen er forbundet med den glomerulære filtreringsproces. På den ene side, fordi det er en del af epitelbelægningen af podocytter, der omgiver de glomerulære kapillærer. Det bidrager også til syntesen af basalmembranen, hvorpå dette epitel og det glomerulære kapillære endotel hviler..
Disse tre strukturer: kapillært endotel, kældermembran og visceralt epitel i Bowmans kapsel udgør den såkaldte filtreringsmembran eller barriere, og hver af dem har sine egne permeabilitetsegenskaber, der bidrager til den globale selektivitet af denne barriere..
Derudover bestemmer væskevolumenet, der trænger ind i Bowmans rum, sammen med graden af stivhed, der modsætter den ydre kapselvæg, dannelsen af et intrakapsulært tryk, der bidrager til at modulere det effektive filtreringstryk og til at drive væsken langs det tilknyttede rør..
Bestemmelser af størrelsen af glomerulær filtrering
En variabel, der samler størrelsen af den glomerulære filtreringsproces, er det såkaldte glomerulære filtreringsvolumen (GFR), som er volumenet af væske, der filtreres gennem alle glomeruli i en tidsenhed. Dens gennemsnitlige normale værdi er ca. 125 ml / min eller 180 L / dag.
Størrelsen af denne variabel bestemmes ud fra det fysiske synspunkt af to faktorer, nemlig den såkaldte filtrering eller ultrafiltreringskoefficient (Kf) og det effektive filtreringstryk (Peff). Det vil sige: VFG = Kf x Peff (ligning 1)
Filtreringskoefficient (Kf)
Filtreringskoefficienten (Kf) er et produkt af den hydrauliske ledningsevne (LP), der måler vandgennemtrængeligheden af en membran i ml / min pr. Enhed og drivtryk, gange overfladearealet (A) af filtreringsmembranen. det vil sige Kf = LP x A (ligning 2).
Størrelsen af filtreringskoefficienten angiver det væskevolumen, der filtreres pr. Tidsenhed og pr. Enhed effektivt drivtryk. Selv om det er meget vanskeligt at måle direkte, kan det fås fra ligning 1, der deler VFG / Peff.
Kf i glomerulære kapillærer er 12,5 ml / min / mmHg pr. C / 100 g væv, en værdi ca. 400 gange højere end Kf for andre kapillarsystemer i kroppen, hvor ca. 0,01 ml / ml kan filtreres. Min / mm Hg pr. 100 g væv. Sammenligning, der viser glomerulær filtreringseffektivitet.
Effektivt filtreringstryk (Peff)
Det effektive filtreringstryk repræsenterer resultatet af den algebraiske sum af de forskellige trykkræfter, der favoriserer eller modsætter sig filtrering. Der er en hydrostatisk trykgradient (AP) og en osmotisk trykgradient (onkotisk, AP) bestemt af tilstedeværelsen af proteiner i plasmaet.
Den hydrostatiske trykgradient er trykforskellen mellem det indre af den glomerulære kapillær (PCG = 50 mm Hg) og rummet i Bowmans kapsel (PCB = 12 mm Hg). Som det kan ses, rettes denne gradient fra kapillæren til kapslen og fremmer forskydning af væske i den retning..
Den osmotiske trykgradient flytter væske fra lavere osmotiske tryk til højere. Kun partikler, der ikke filtrerer, har denne effekt. Proteiner filtreres ikke. Dens ПCB er 0 og i den glomerulære kapillær er ПCG 20 mm Hg. Denne gradient flytter væske fra kapslen til kapillær.
Det effektive tryk kan beregnes ved at anvende Peff = ΔP-ΔП; = (PCG-PCB) - (ПCG-ПCB); = (50-12) - (20-0); = 38-20 = 18 mm Hg. Der er således et effektivt eller nettofiltreringstryk på ca. 18 mm Hg, der bestemmer en GFR på ca. 125 ml / min..
Filtreringsindeks (IF) for stoffer, der er til stede i plasma
Det er en indikator for, hvor let (eller vanskeligheden) et stof i plasma kan krydse filtreringsbarrieren. Indekset opnås ved at dividere koncentrationen af stoffet i filtratet (FX) med dets koncentration i plasmaet (PX), det vil sige: IFX = FX / PX.
Intervallet for IF-værdier er mellem maksimalt 1 for de stoffer, der filtrerer frit, og 0 for dem, der slet ikke filtrerer. Mellemliggende værdier er for partikler med mellemliggende vanskeligheder. Jo tættere på 1 værdien, jo bedre er filtreringen. Tættere på 0, sværere at filtrere.
En af de faktorer, der bestemmer IF er partikelstørrelsen. Dem med diametre mindre end 4 nm filtrerer frit (IF = 1). Efterhånden som størrelsen bliver tættere på albumins størrelse, falder IF. Partikler i størrelse i albumin eller større har IF'er på 0.
En anden faktor, der bidrager til bestemmelse af IF, er negative elektriske ladninger på den molekylære overflade. Proteiner er meget negativt ladede, hvilket øger deres størrelse for at gøre det vanskeligt at filtrere. Årsagen er, at porerne har negative ladninger, der afviser proteinerne.
Referencer
- Ganong WF: Renal Function and Micturition, i Gennemgang af medicinsk fysiologi, 25. udgave New York, McGraw-Hill Uddannelse, 2016.
- Guyton AC, Hall JE: Urinvejene, i Lærebog i medicinsk fysiologi , 13. udgave, AC Guyton, JE Hall (red.). Philadelphia, Elsevier Inc., 2016.
- Lang F, Kurtz A: Niere, i Physiologie des Menschen mit Pathophysiologie, 31. udgave, RF Schmidt et al (red.). Heidelberg, Springer Medizin Verlag, 2010.
- Silbernagl S: Die funktion der nieren, in Fysiologi, 6. udgave; R Klinke et al. (Red.). Stuttgart, Georg Thieme Verlag, 2010.
- Stahl RAK et al: Niere und ableitende Harnwege, i Klinische Pathophysiologie, 8. udgave, W Siegenthaler (red.). Stuttgart, Georg Thieme Verlag, 2001.


Endnu ingen kommentarer