
Chromegenskaber, egenskaber og anvendelser

Det krom (Cr) er et metalelement i gruppe 6 (VIB) i det periodiske system. Ton af dette metal produceres årligt ved ekstraktion fra mineralet chromitjern eller magnesium (FeCrtoELLER4, MgCrtoELLER4), som reduceres med kulstof for at opnå metallet. Det er meget reaktivt, og kun under meget reducerende forhold findes det i sin rene form.
Navnet stammer fra det græske ord 'chroma', hvilket betyder farve. Det fik dette navn på grund af de mange og intense farver, der blev vist af chromforbindelser, hvad enten de var uorganiske eller organiske; fra sorte faste stoffer eller opløsninger til gul, orange, grøn, lilla, blå og rød.

Imidlertid er farven på metallisk krom og dens karbider sølvgrå. Denne egenskab udnyttes i forkromningsteknikken for at give mange strukturer sølvglitter (som dem der ses i krokodillen på billedet ovenfor). Ved at "bade med krom" får stykkerne således glans og en stor modstandsdygtighed mod korrosion..
Krom i opløsning reagerer hurtigt med ilt i luften til dannelse af oxider. Afhængigt af pH og oxidative forhold i mediet kan det erhverve forskellige oxidationstal, idet de er (III) (Cr3+) den mest stabile af alle. Derfor er chrom (III) oxid (CrtoELLER3) grøn farve er den mest stabile af dets oxider.
Disse oxider kan interagere med andre metaller i miljøet og forårsage for eksempel pigmentet sibirisk rød bly (PbCrO4). Dette pigment er gul-orange eller rødt (i henhold til dets alkalinitet), og derfra isolerede den franske videnskabsmand Louis Nicolas Vauquelin metallisk kobber, hvorfor han tildeles som opdageren.
Dets mineraler og oxider såvel som en lille del af metallisk kobber får dette element til at indtage nummer 22 af de mest rigelige i jordskorpen..
Kromens kemi er meget forskelligartet, fordi det kan danne bindinger med næsten hele det periodiske system. Hver af dets forbindelser udviser farver, der afhænger af oxidationsnummeret, såvel som de arter, der interagerer med det. Ligeledes danner det bindinger med kulstof, der griber ind i et stort antal organometalliske forbindelser..
[TOC]
Egenskaber og egenskaber
Krom er et sølvfarvet metal i sin rene form med et atomnummer på 24 og en molekylvægt på ca. 52 g / mol (52Cr, dens mest stabile isotop).
På grund af sine stærke metalliske bindinger har den høje smeltepunkter (1907 ºC) og kogepunkter (2671 ºC). Desuden gør dens krystallinske struktur det til et meget tæt metal (7,19 g / ml).
Det reagerer ikke med vand til dannelse af hydroxider, men det reagerer med syrer. Det oxiderer med iltet i luften og producerer generelt chromoxid, som er et meget anvendt grønt pigment..
Disse oxidlag skaber det, der kaldes passivering, beskytter metallet mod efterfølgende korrosion, da ilt ikke kan trænge igennem sinusmetallet.
Dens elektronkonfiguration er [Ar] 4s13d5, med alle elektroner uparrede og udviser derfor paramagnetiske egenskaber. Parringen af elektroniske spins kan dog forekomme, hvis metallet udsættes for lave temperaturer og erhverver andre egenskaber såsom antiferromagnetisme.
Artikelindeks
- 1 Egenskaber og egenskaber
- 2 Kemisk struktur af krom
- 3 oxidationsnummer
- 3,1 Cr (-2, -1 og 0)
- 3.2 Cr (I) og Cr (II)
- 3,3 Cr (III)
- 3,4 Cr (IV) og Cr (V)
- 3,5 Cr (VI): kromat-dikromatparret
- 4 Anvendelser af krom
- 4.1 Som farvestof eller pigmenter
- 4.2 I forkromning eller metallurgi
- 4.3 Ernæringsmæssige
- 5 Hvor er?
- 6 Referencer
Chrom kemisk struktur
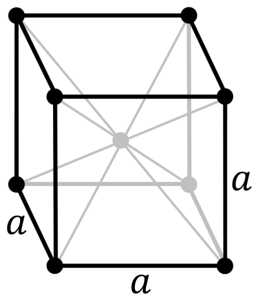
Hvad er strukturen af krommetal? I sin rene form antager krom en kropscentreret kubisk (cc eller bcc) krystalstruktur. Dette betyder, at kromatomet er placeret i midten af en terning, hvis kanter er optaget af andre krom (som på billedet ovenfor).
Denne struktur er ansvarlig for krom med høje smelte- og kogepunkter samt stor hårdhed. Kobberatomer overlapper deres s og d orbitaler for at danne ledningsbånd i henhold til båndteori.
Således er begge bands halvt fulde. Hvorfor? Fordi dens elektronkonfiguration er [Ar] 4s13d5 og som s orbital kan huse to elektroner, og d orbitaler ti. Derefter er kun halvdelen af båndene dannet af deres overlapninger optaget af elektroner..
Med disse to perspektiver - den krystallinske struktur og den metalliske binding - kan mange af dette metals fysiske egenskaber forklares i teorien. Imidlertid forklarer ingen af dem, hvorfor krom kan have forskellige oxidationstilstande eller -tal..
Dette ville kræve en dyb forståelse af atomets stabilitet med hensyn til elektroniske spins..
Oxidationsnummer
Fordi elektronkonfigurationen af krom er [Ar] 4s13d5 kan få op til en eller to elektroner (Cr1- og CRto-) eller mister dem for at erhverve forskellige oxidationsnumre.
Således, hvis krom mister en elektron, ville den forblive som [Ar] 4s03d5; hvis han mister tre, [Ar] 4s03d3; og hvis det mister dem alle, [Ar], eller hvad der er lige, ville det være isoelektronisk at argonere.
Krom mister ikke eller vinder elektroner ved blot indfald: der skal være en art, der donerer eller accepterer dem for at gå fra et oxidationsnummer til et andet.
Krom har følgende oxidationsnumre: -2, -1, 0, +1, +2, +3, +4, +5 og +6. Af dem +3, Cr3+, den er den mest stabile og derfor fremherskende af alle; efterfulgt af +6, Cr6+.
Cr (-2, -1 og 0)
Det er meget usandsynligt, at krom vinder elektroner, da det er et metal, og derfor er dets natur at donere dem. Det kan imidlertid koordinere med ligander, det vil sige molekyler, der interagerer med metalcentret gennem en dativbinding..
En af de bedst kendte er kulilte (CO), der danner hexacarbonylforbindelsen af krom.
Denne forbindelse har molekylformlen Cr (CO)6, og da liganderne er neutrale og ikke tilvejebringer nogen ladning, har Cr et oxidationsnummer på 0.
Dette kan også observeres i andre organometalliske forbindelser såsom bis (benzen) krom. I sidstnævnte er krom omgivet af to benzenringe i en molekylær struktur af sandwich-typen:
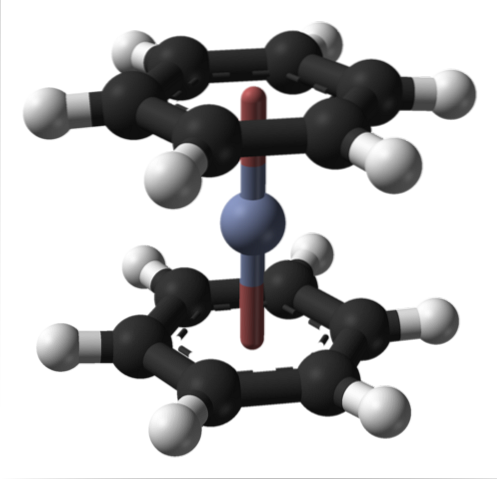
Fra disse to organometalliske forbindelser kan mange andre opstå fra Cr (0).
Salte er fundet, hvor de interagerer med natriumkationer, hvilket betyder, at Cr skal have et negativt oxidationsnummer for at tiltrække positive ladninger: Cr (-2), Nato[Cr (CO)5] og Cr (-1), Nato[Crto(CO)10].
Cr (I) og Cr (II)
Cr (I) eller Cr1+ Det produceres ved oxidation af de netop beskrevne organometalliske forbindelser. Dette opnås ved oxiderende ligander, såsom CN eller NO, hvorved der for eksempel dannes forbindelse K3[Cr (CN)5IKKE].
Her er det faktum at have tre K-kationer+ Det antyder, at chromkomplekset har tre negative ladninger; liganden CN- bidrager med fem negative ladninger, så mellem Cr og NO skal tilføje to positive ladninger (-5 + 2 = -3).
Hvis NO er neutralt, er det Cr (II), men hvis det har en positiv ladning (NO+), er i så fald Cr (I).
På den anden side er Cr (II) forbindelser mere rigelige, herunder følgende: chrom (II) chlorid (CrClto), kromacetat (Crto(ELLERtoCCH3)4), krom (II) oxid (CrO), krom (II) sulfid (CrS) og mere.
Cr (III)
Af alt er det den, der har den største stabilitet, da den faktisk er resultatet af mange oxidative reaktioner af kromationer. Måske skyldes dens stabilitet dens elektroniske konfiguration d3, hvor tre elektroner optager tre orbitaler med lavere energi sammenlignet med de andre to mere energiske (opdeling af d-orbitaler).
Den mest repræsentative forbindelse med dette oxidationsnummer er chrom (III) oxid (CrtoELLER3). Afhængigt af de ligander, der koordinerer med det, udviser komplekset en eller anden farve. Eksempler på disse forbindelser er: [CrClto(HtoELLER)4Cl, Cr (OH)3, CrF3, [Cr (HtoELLER)6]3+, etc.
Selvom den kemiske formel ikke viser det ved første øjekast, har krom normalt en oktaedrisk koordinationssfære i sine komplekser; det vil sige, det er placeret i midten af en oktaeder, hvor dens hjørner er placeret af liganderne (i alt seks).
Cr (IV) og Cr (V)
Forbindelserne, hvor Cr deltager5+ er meget få på grund af den elektroniske ustabilitet af atomet, ud over at det let oxideres til Cr6+, meget mere stabil, da den er isoelektronisk sammenlignet med argon ædelgas.
Cr (V) -forbindelser kan imidlertid syntetiseres under visse betingelser, såsom højt tryk. Ligeledes har de en tendens til at nedbrydes ved moderate temperaturer, hvilket gør deres mulige anvendelser umulige, da de ikke har termisk modstand. Nogle af dem er: CrF5 og K3[Cr (Oto)4] (Ototo- er peroxidanionen).
På den anden side er Cr4+ det er relativt mere stabilt, idet det er i stand til at syntetisere dets halogenerede forbindelser: CrF4, CrCl4 og CrBr4. Imidlertid er de også modtagelige for at blive nedbrudt af redoxreaktioner for at producere chromatomer med bedre oxidationstal (såsom +3 eller +6)..
Cr (VI): kromat-dikromatparret
2 [CrO4]to- + 2H+ (Gul) => [CrtoELLER7]to- + HtoO (orange)
Ovenstående ligning svarer til syredimeriseringen af to chromationer til dannelse af dichromat. Variationen i pH forårsager en ændring i interaktionerne omkring metalcentret i Cr6+, også tydelig i opløsningens farve (fra gul til orange eller omvendt). Dichromate består af en O-bro3Cr-O-CrO3.
Cr (VI) forbindelser har de egenskaber, at de er skadelige og endda kræftfremkaldende for den menneskelige krop og dyr.
Hvordan? Undersøgelser hævder, at CrO-ioner4to- krydse cellemembraner ved virkningen af sulfattransporterende proteiner (begge ioner er faktisk ens i størrelse).
Reduktionsmidler i celler reducerer Cr (VI) til Cr (III), som akkumuleres ved irreversibelt at koordinere til specifikke steder på makromolekyler (såsom DNA).
Forurenet cellen med et overskud af krom, den kan ikke forlade på grund af den manglende mekanisme, der transporterer den tilbage gennem membranerne.
Krom bruger
Som farvestof eller pigmenter
Chrom har en bred vifte af applikationer, lige fra farvestoffer til forskellige typer stoffer, til beskytter, der pynter metaldele i såkaldt forkromning, som kan fremstilles med rent metal eller med Cr (III) forbindelser eller Cr (VI).
Kromfluorid (CrF3) anvendes f.eks. som farvestof til uldklude; kromsulfat (Crto(SW4)3), det bruges til at farve emaljer, keramik, maling, blæk, lak, og det bruges også til krommetaller; og chromoxid (CrtoELLER3) finder også anvendelse, hvor dens attraktive grønne farve er påkrævet.
Derfor kan ethvert krommineral med intense farver være bestemt til at plette en struktur, men derefter opstår det faktum, om disse forbindelser er farlige eller ikke for miljøet eller for enkeltpersoner..
Faktisk bruges dets giftige egenskaber til at bevare træ og andre overflader mod insektangreb..
I krom eller metallurgi
Små mængder krom tilsættes også til stålet for at styrke det mod oxidation og for at forbedre dets glans. Dette skyldes, at det er i stand til at danne grålig karbider (Cr3Cto) meget modstandsdygtig over for reaktion med ilt i luften.
Fordi krom kan poleres til skinnende overflader, har krom derefter sølvdesign og farver som et billigere alternativ til disse formål..
Ernæringsmæssige
Nogle diskuterer, om krom kan betragtes som et essentielt element, dvs. uundværlig i den daglige diæt. Det er til stede i nogle fødevarer i meget små koncentrationer, såsom grønne blade og tomater..
Ligeledes er der proteintilskud, der regulerer insulinaktivitet og fremmer muskelvækst, som det er tilfældet med chrom polynicotinate.
Hvor er det placeret?

Krom findes i en lang række mineraler og ædelstene, såsom rubiner og smaragder. Det vigtigste mineral, hvorfra chrom ekstraheres, er krom (MCrtoELLER4hvor M kan være et hvilket som helst andet metal, som chromoxid er forbundet med. Disse miner findes i overflod i Sydafrika, Indien, Tyrkiet, Finland, Brasilien og andre lande.
Hver kilde har en eller flere varianter af krom. På denne måde opstår et forskelligt krommineral for hvert M (Fe, Mg, Mn, Zn osv.).
For at ekstrahere metallet er det nødvendigt at reducere mineralet, det vil sige at få krommetalcentret til at få elektroner ved hjælp af et reduktionsmiddel. Dette gøres med kulstof eller aluminium:
FeCrtoELLER4 + 4C => Fe + 2Cr + 4CO
Også krom (PbCrO4).
Generelt i ethvert mineral, hvor Cr ion3+ kan erstatte Al3+, begge med lidt lignende ioniske radier, udgør en urenhed, der resulterer i en anden naturlig kilde til dette fantastiske, men skadelige metal.
Referencer
- Tenenbaum E. Krom. Hentet fra: chemistry.pomona.edu
- Wikipedia. (2018). Krom. Hentet fra: en.wikipedia.org
- Anne Marie Helmenstine, Ph.D. (6. april 2018). Hvad er forskellen mellem Chrome og Chrom? Hentet fra: thoughtco.com
- N.V. Mandich. (nitten femoghalvfems). Kemi af krom. [PDF]. Hentet fra: citeseerx.ist.psu.edu
- Kemi LibreTexts. Kemi af krom. Hentet fra: chem.libretexts.org
- Saul 1. Shupack. (1991). Kemi af krom og nogle resulterende analytiske problemer. Anmeldt fra: ncbi.nlm.nih.gov
- Advameg, Inc. (2018). Krom. Hentet fra: chemistryexplained.com



Endnu ingen kommentarer