
Zinkfingers struktur, klassificering, funktion og betydning
Det zinkfingre (ZF) er strukturelle motiver, der findes i et stort antal eukaryote proteiner. De tilhører gruppen af metalloproteiner, da de er i stand til at binde zinkmetalionen, som de har brug for til deres drift. Mere end 1.500 ZF-domæner forudsiges at eksistere i omkring 1.000 forskellige proteiner hos mennesker..
Udtrykket zinkfinger eller "zinkfinger" blev først opfundet i 1985 af Miller, McLachlan og Klug, mens de små DNA-bindende domæner i transkriptionsfaktoren TFIIIA af Xenopus laevis, beskrevet af andre forfattere nogle år før.
Proteiner med ZF-motiver er blandt de mest forekommende i genomet af eukaryote organismer og deltager i en række essentielle cellulære processer, herunder gentranskription, proteintranslation, metabolisme, foldning og samling af andre proteiner og lipider., Programmeret celledød blandt andre.
Artikelindeks
- 1 Struktur
- 2 Klassificering
- 2.1 C2H2
- 2.2 C2H
- 2.3 C4 (bue eller bånd)
- 2.4 C4 (GATA-familie)
- 2,5 C6
- 2.6 Zinkfingre (C3HC4-C3H2C3)
- 2,7 H2C2
- 3 funktioner
- 4 Bioteknologisk betydning
- 5 Referencer
Struktur
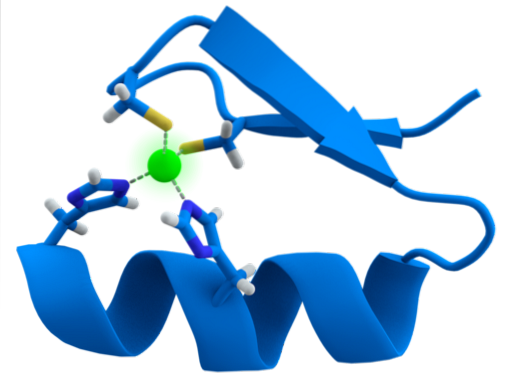
ZF-motivets struktur er yderst bevaret. Normalt har disse gentagne regioner 30 til 60 aminosyrer, hvis sekundære struktur findes som to antiparallelle beta-ark, der danner en hårnål og en alfa-helix, der betegnes som ββα.
Nævnte sekundære struktur er stabiliseret ved hydrofobe interaktioner og ved koordinering af et zinkatom givet af to cystein- og to histidinrester (CystoHansto). Der er dog ZF'er, der kan koordinere mere end et zinkatom og andre, hvor rækkefølgen af Cys og hans rester varierer..
ZF'erne kan findes gentaget i batches, lineært konfigureret i det samme protein. Alle har lignende strukturer, men kan skelnes kemisk fra hinanden ved variationer af aminosyrerester, der er nøglen til udførelsen af deres funktioner.
Et fælles træk blandt ZF'er er deres evne til at genkende DNA- eller RNA-molekyler med forskellige længder, hvorfor de oprindeligt kun blev betragtet som transkriptionsfaktorer.
Generelt er genkendelse af 3bp-regioner i DNA og opnås, når proteinet med ZF-domæne præsenterer alfa-helixen til DNA-molekylets hovedrille.
Klassifikation
Der er forskellige ZF-motiver, der adskiller sig fra hinanden på grund af deres natur og de forskellige rumlige konfigurationer, der opnås ved koordineringsbåndene med zinkatomet. En af klassifikationerne er som følger:
CtoHto
Dette er et almindeligt fundet motiv i ZF'er. De fleste C-motivertoHto De er specifikke for interaktion med DNA og RNA, men det er observeret, at de deltager i protein-protein-interaktioner. De har mellem 25 og 30 aminosyrerester og findes inden for den største familie af regulatoriske proteiner i pattedyrceller.
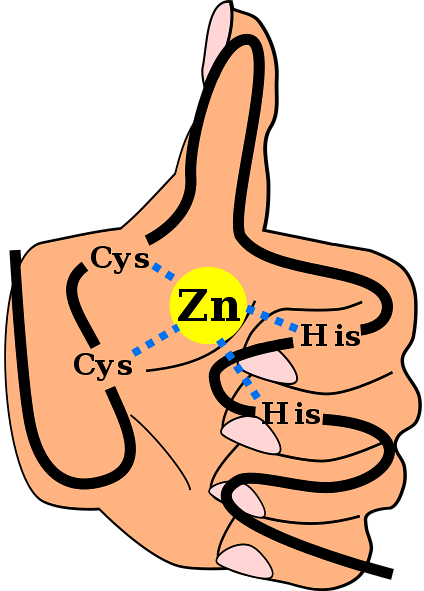
CtoH
De interagerer med RNA og nogle andre proteiner. De observeres hovedsageligt som en del af nogle retroviruscapsidproteiner, der hjælper med at pakke viralt RNA lige efter replikation..
C4 (bue eller bånd)
Proteiner med dette motiv er enzymer, der er ansvarlige for DNA-replikation og transkription. Et godt eksempel på disse kan være de grove enzymer i fag T4 og T7.
C4 (GATA familie)
Denne ZF-familie omfatter transkriptionsfaktorer, der regulerer ekspressionen af vigtige gener i adskillige væv under celleudvikling. Faktorer GATA-2 og 3 er for eksempel involveret i hæmatopoiesis.
C6
Disse domæner er typiske for gær, specifikt GAL4-proteinet, som aktiverer transkriptionen af gener involveret i brugen af galactose og melibiose..
Zinc Fingers (C3HC4-C3HtoC3)
Disse særlige strukturer har 2 undertyper af ZF-domæner (C3HC4 og C3HtoC3) og er til stede i adskillige animalske og planteproteiner.
De findes i proteiner som RAD5, involveret i DNA-reparation i eukaryote organismer. De findes også i RAG1, der er essentielle for omkonfiguration af immunglobuliner.
HtoCto
Dette domæne af ZF er stærkt konserveret i integraser af retrovira og retrotransposoner; ved binding til målproteinet forårsager det en konformationsændring i det.
Funktioner
Proteiner med ZF-domæner tjener forskellige formål: de kan findes i ribosomale proteiner eller i transkriptionsadaptere. De er også blevet påvist som en integreret del af strukturen af gær-RNA-polymerase II..
De ser ud til at være involveret i intracellulær zinkhomeostase og i reguleringen af apoptose eller programmeret celledød. Derudover er der nogle proteiner med ZF, der fungerer som chaperoner til foldning eller transport af andre proteiner..
Binding til lipider og en grundlæggende rolle i protein-protein-interaktioner er også fremtrædende funktioner i ZF-domænerne i nogle proteiner..
Bioteknologisk betydning
I årenes løb har den strukturelle og funktionelle forståelse af ZF-domænerne muliggjort store videnskabelige fremskridt, der involverer brugen af deres egenskaber til bioteknologiske formål..
Da nogle proteiner med ZF har en høj specificitet for visse DNA-domæner, investeres der i øjeblikket meget arbejde i designet af specifikke ZF'er, som kan give værdifulde fremskridt inden for genterapi hos mennesker..
Interessante bioteknologiske anvendelser stammer også fra design af proteiner med genetisk konstruerede ZF'er. Afhængig af det ønskede formål kan nogle af disse modificeres ved tilsætning af "polyzink" fingerpeptider, som er i stand til at genkende praktisk talt enhver DNA-sekvens med høj affinitet og specificitet..
Nuklease-modificeret genomisk redigering er en af de mest lovende applikationer i dag. Denne type redigering giver mulighed for at udføre undersøgelser af genetisk funktion direkte i det interesserede modelsystem..
Genteknik ved hjælp af modificerede ZF-nukleaser har fanget forskernes opmærksomhed inden for genetisk forbedring af sorter af planter af agronomisk betydning. Disse nukleaser er blevet brugt til at korrigere et endogent gen, der producerer herbicidresistente former i tobaksplanter..
Nukleaser med ZF er også blevet anvendt til tilsætning af gener i pattedyrceller. De pågældende proteiner blev brugt til at generere et sæt isogene museceller med en række alleler defineret for et endogent gen..
En sådan proces har en direkte anvendelse i mærkning og oprettelse af nye allelformer til at studere forholdet mellem struktur og funktion under native ekspressionsbetingelser og i isogene miljøer..
Referencer
- Berg, J. M. (1990). Zinkfinger-domæner: hypoteser og nuværende viden. Årlig gennemgang af biofysik og biofysisk kemi, 19(39), 405-421.
- Dreier, B., Beerli, R., Segal, D., Flippin, J., & Barbas, C. (2001). Udvikling af zinkfinger domæner til genkendelse af 5'-ANN-3 'familien af DNA-sekvenser og deres anvendelse i konstruktionen af kunstige transkriptionsfaktorer. JBC, (54).
- Gamsjaeger, R., Liew, C. K., Loughlin, F. E., Crossley, M., & Mackay, J. P. (2007). Sticky fingers: zink-fingers som proteingenkendelsesmotiver. Tendenser i biokemiske videnskaber, 32(2), 63-70.
- Klug, A. (2010). Opdagelsen af zinkfingre og deres anvendelser i genregulering og genommanipulation. Årlig gennemgang af biokemi, 79(1), 213-231.
- Kluska, K., Adamczyk, J., & Krȩzel, A. (2017). Metalbindingsegenskaber for zinkfingre med et naturligt ændret metalbindingssted. Metallomics, 10(2), 248-263.
- Laity, J. H., Lee, B. M., og Wright, P. E. (2001). Zinkfingerproteiner: Ny indsigt i strukturel og funktionel mangfoldighed. Nuværende mening inden for strukturbiologi, elleve(1), 39-46.
- Miller, J., McLachlan, A. D., & Klug, A. (1985). Gentagne zinkbindende domæner i proteintranskriptionsfaktor IIIA fra Xenopus-oocytter. Journal of Trace Elements in Experimental Medicine, 4(6), 1609-1614.
- Urnov, F. D., Rebar, E. J., Holmes, M. C., Zhang, H. S. og Gregory, P. D. (2010). Genomredigering med manipulerede zinkfingernukleaser. Naturanmeldelser Genetik, elleve(9), 636-646.



Endnu ingen kommentarer