
Gibbs gratis energienheder, hvordan man beregner det, løste øvelser
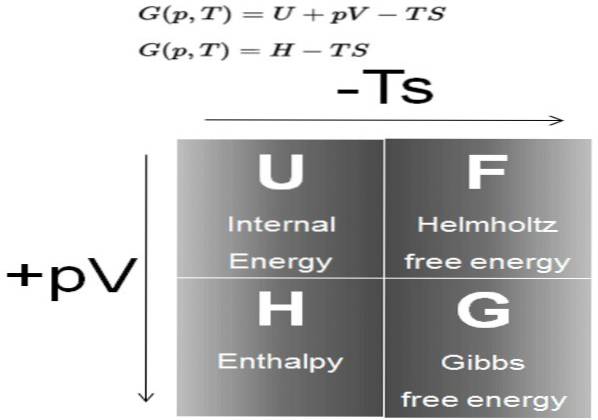
Det Gibbs fri energi (almindeligvis kaldet G) er et termodynamisk potentiale defineret som forskellen mellem entalpi H minus produktet af temperaturen T ved systemets entropi S:
G = H - T S
Gibbs fri energi måles i Joule (ifølge det Internationale System), i ergs (for Cegesimal System of Units), i kalorier eller i elektronvolt (til elektrovolt).
I processer, der forekommer ved konstant tryk og temperatur, er variationen af Gibbs fri energi ΔG = ΔH - T ΔS. I sådanne processer repræsenterer (G) den tilgængelige energi i systemet, der kan omdannes til arbejde.
For eksempel i eksotermiske kemiske reaktioner, falder entalpi, mens entropi øges. I Gibbs-funktionen modvirkes disse to faktorer, men først når Gibbs-energien falder, forekommer reaktionen spontant..
Så hvis variationen af G er negativ, er processen spontan. Når Gibbs-funktionen når sit minimum, når systemet en stabil ligevægtstilstand. Sammenfattende kan vi i en proces, hvor tryk og temperatur forbliver konstant, bekræfte:
- Hvis processen er spontan, så ΔG < 0
- Når systemet er i ligevægt: ΔG = 0
- I en ikke-spontan proces øges G: ΔG> 0.
Artikelindeks
- 1 Hvordan beregnes det?
- 1.1 - Trin for trin
- 1.2 - Maxwells termodynamiske forhold
- 2 Løst øvelser
- 2.1 Øvelse 1
- 2.2 Øvelse 2
- 2.3 Øvelse 3
- 3 Referencer
Hvordan beregnes det?
Gibbs fri energi (G) beregnes ved hjælp af den definition, der blev givet i begyndelsen:
G = H - T⋅S
Til gengæld er entalpi H et termodynamisk potentiale defineret som:
H = U + P V
- Trin for trin
Derefter foretages en trinvis analyse for at kende de uafhængige variabler, som Gibbs-energien er en funktion af:
1- Fra den første lov om termodynamik har vi, at den indre energi U er relateret til entropien S i systemet og dets volumen V for reversible processer gennem det differentielle forhold:
dU = dQ - dW = TdS - PdV
Fra denne ligning følger det, at den indre energi U er en funktion af variablerne S og V:
U = U (S, V)
2- Startende med definitionen af H og udtagning af differens får vi:
dH = dU + d (P V) = dU + VdP + PdV
3- Ved at erstatte udtrykket for dU opnået i (1) har vi:
dH = TdS - PdV + VdP + PdV = TdS + VdP
Ud fra dette konkluderes det, at entalpi H afhænger af entropien S og trykket P, det vil sige:
H = H (S, P)
4- Nu beregnes den samlede forskel på Gibbs fri energi for at opnå:
dG = dH -TdS -SdT = TdS + VdP -TdS -SdT
Hvor dH er blevet erstattet af udtrykket, der findes i (3).
5- Endelig når vi forenkler, opnår vi: dG = VdP - SdT, at være klar over, at den frie energi G afhænger af trykket og temperaturen T som:
G = G (P, T)
- Maxwells termodynamiske forhold
Af analysen i det foregående afsnit følger det, at et systems indre energi er en funktion af entropi og volumen:
U = U (S, V)
Så differentieringen af ELLER vil være:
dU = ∂SU |V dS + ∂VU |S dV = TdS - PdV
Fra dette delvise afledte udtryk kan de såkaldte Maxwell termodynamiske relationer afledes. Delderivater gælder, når en funktion afhænger af mere end en variabel og beregnes let ved at anvende sætningen i det næste afsnit.
Maxwells første forhold
∂VT |S = -∂SP |V
For at nå frem til dette forhold, Clairaut-Schwarz sætning på delderivater, der angiver følgende:
"De blandede derivater af anden orden med de udskiftede variabler er ens, så længe de funktioner, der skal afledes, er kontinuerlige og differentierbare".
Maxwells andet forhold
Baseret på hvad der er vist i punkt 3 i forrige afsnit:
H = H (S, P) og dH = TdS + VdP
Det kan fås:
∂PT |S = ∂SV |P
Vi fortsætter på en lignende måde med Gibbs fri energi G = G (P, T) og med Helmholtz fri energi F = F (T, V) for at opnå de to andre Maxwell termodynamiske forhold.

Maxwells fire termodynamiske forhold
1- Associeret med den interne energi U: ∂VT |S = -∂SP |V
2- Den ene opnået fra entalpi H: ∂PT |S = ∂SV |P
3- Relateret til Helmholtz energi F: ∂TP |V = ∂VS |T
4- Koblet til Gibbs fri energi G: ∂TV |P = -∂PS |T
Løst øvelser
Øvelse 1
Beregn variationen af Gibbs fri energi for 2 mol ideel gas ved en temperatur på 300 K under en isoterm ekspansion, der fører systemet fra et indledende volumen på 20 liter til et slutvolumen på 40 liter.
Opløsning
Vi minder om definitionen af Gibbs fri energi:
G = H - T S
Derefter vil en endelig variation af F være:
ΔG = ΔH - T ΔS, siden ΔT = 0
I ideelle gasser afhænger entalpi kun af dens absolutte temperatur, men da det er en isoterm proces, er ΔH = 0 og ΔG = - T ΔS.
For ideelle gasser er entropiændringen af en isoterm proces:
ΔS = nR ln (V.to/ V1)
Det, der gælder for denne øvelses sag, er fortsat:
ΔS = 2 mol x 8,314 J / (K mol) x ln (40L / 20L) = 11,53 J / K
Så kan vi få ændringen i Helmholtz energi:
ΔG = - 300K x 11,53 J / K = -3457,70 J.
Øvelse 2
Under hensyntagen til, at Gibbs fri energi er en funktion af temperatur og tryk G = G (T, P); bestemme variationen af G under en proces, hvor temperaturen ikke ændres (isotermisk) for n mol af en monatomisk idealgas.
Opløsning
Som vist ovenfor afhænger ændringen i Gibbs energi kun af ændringen i temperatur T og volumen V, så en uendelig minimal variation af den beregnes i henhold til:
dG = -SdT + VdP
Men hvis det er en proces, hvor temperaturen er konstant, så dF = + VdP, så en endelig trykvariation ΔP fører til en ændring i Gibbs-energi givet ved:
ΔG = + ∫ VdP = + ∫ (n R T) dP / P = + n R T ln (AP)
Brug af den ideelle gasligning:
P V = n R T
Under en isoterm proces opstår det at:
d (P V) = P dV + V dP = 0
Det er:
dP / P = - dV / V
Så ovenstående resultat kan skrives som en funktion af volumenvariationen AV:
ΔG = + ∫ VdP = + ∫ (n R T) dP / P = - ∫ (n R T) dV / V = -n R T ln (AV)
Øvelse 3
I betragtning af følgende kemiske reaktion:
Nto0 (g) + (3/2) Oto (g) ↔️ 2NOto (g) ved temperatur T = 298 K
Find variationen i Gibbs fri energi, og brug det opnåede resultat til at angive, om det er en spontan proces eller ej.
Opløsning
Her er trinene:
- Trin et: Reaktionens entalpier
ΔHr = 2 * ΔH (NOto (g)) - ΔH (Nto0 (g)) = 2 * 33,2-81,6 = -15,2 kJ / mol
- Andet trin: reaktion entropi variation
ΔSr = 2 * S (NOto (g)) - S (Nto0 (g)) - (3/2) S (Oto (g)) = 2 * 240,1 - 220,1 - 1,5 * 205,2 = -47,7 J / (mol * K).
- Tredje trin: variation i Gibbs-funktionen
Denne værdi vil bestemme balancen mellem den faldende energi og den stigende entropi for at vide, om reaktionen endelig er spontan eller ej.
ΔGr = ΔHr - T ΔSr = -15,2 -298 * (- 47,7) = -985,4 J / mol
Da det er en negativ variation af Gibbs-energien, kan det konkluderes, at det er en spontan reaktion ved temperaturen 298 K = 25 ºC.
Referencer
- Kastanjer E. Gratis energiøvelser. Gendannet fra: lidiaconlaquimica.wordpress.com.
- Cengel, Y. 2012. Termodynamik. 7. udgave. Mcgraw bakke.
- Libretexts. Gibbs fri energi. Gendannet fra: chem.libretexts.org
- Libretexts. Hvad er gratis energier. Gendannet fra: chem.libretexts.org
- Wikipedia. Gibbs fri energi. Gendannet fra: es.wikipedia.com
- Wikipedia. Gibbs fri energi. Gendannet fra: en.wikipedia.com


Endnu ingen kommentarer