
Polære kovalente bindingsegenskaber og eksempler

EN polær kovalent binding Det er den, der dannes mellem to kemiske grundstoffer, hvis elektronegativitetsforskel er betydelig, men uden at nærme sig en rent ionisk karakter. Det er derfor en stærk mellemliggende interaktion mellem de apolare kovalente bindinger og de ioniske bindinger..
Det siges at være kovalent, fordi der i teorien er en lige deling af et elektronisk par mellem de to bundne atomer; de to elektroner deles ligeligt. Atomet E donerer en elektron, mens X bidrager med den anden elektron til dannelse af den kovalente binding E: X eller E-X.
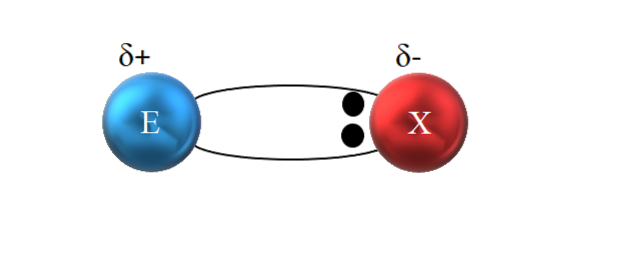
Som det fremgår af billedet ovenfor er de to elektroner imidlertid ikke placeret i midten af E og X, hvilket indikerer, at de "cirkulerer" med den samme frekvens mellem begge atomer; snarere er de tættere på X end på E. Dette betyder, at X har tiltrukket elektronparret mod sig selv på grund af dets højere elektronegativitet.
Da bindingselektronerne er tættere på X end E, dannes omkring X et område med høj elektrondensitet, δ-; mens i E vises en elektronfattig region, δ +. Derfor er der en polarisering af elektriske ladninger: en polær kovalent binding.
Artikelindeks
- 1 Funktioner
- 1.1 Grad af polaritet
- 1.2 Kemiske grundstoffer, der stammer fra dem
- 1.3 Polar og ionisk karakter
- 2 Eksempler på polær kovalent binding
- 2.1 C-O
- 2.2 H-X
- 2.3 O-H
- 2,4 N-H
- 2,5 Fe-O
- 3 Referencer
Egenskaber
Grader af polaritet
Kovalente bindinger er meget rigelige i naturen. De er til stede i praktisk talt alle heterogene molekyler og kemiske forbindelser; da det til sidst dannes, når to forskellige atomer E og X binder. Der er imidlertid kovalente bindinger, der er mere polære end andre, og for at finde ud af, skal man ty til elektronegativiteter.
Jo mere elektronegativ X er, og jo mindre elektronegativ E er (elektropositiv), så vil den resulterende kovalente binding være mere polær. Den konventionelle måde at estimere denne polaritet på er gennem formlen:
χx - χOG
Hvor χ er elektronegativiteten for hvert atom i henhold til Pauling-skalaen.
Hvis denne subtraktion eller subtraktion har værdier mellem 0,5 og 2, vil det være en polær binding. Derfor er det muligt at sammenligne graden af polaritet mellem forskellige E-X-links. Hvis den opnåede værdi er højere end 2, taler vi om en ionbinding, E.+x- Og det er det ikkeδ+-xδ-.
Imidlertid er polariteten af E-X-bindingen ikke absolut, men afhænger af de molekylære omgivelser; det vil sige i et molekyle -E-X-, hvor E og X danner kovalente bindinger med andre atomer, har sidstnævnte direkte indflydelse på graden af polaritet.
Kemiske grundstoffer, der stammer fra dem
Selvom E og X kan være et hvilket som helst element, forårsager ikke alle polære kovalente bindinger. For eksempel, hvis E er et stærkt elektropositivt metal, såsom de alkaliske (Li, Na, K, Rb og Cs), og X er et halogen (F, Cl, Br og I), vil de have tendens til at danne ioniske forbindelser (Na+Cl-) og ingen molekyler (Na-Cl).
Derfor findes polære kovalente bindinger normalt mellem to ikke-metalliske grundstoffer; og i mindre grad mellem ikke-metalliske grundstoffer og nogle overgangsmetaller. Ser på blokken s i det periodiske system har du mange muligheder for at danne disse typer kemiske bindinger.
Polar og ionisk karakter
I store molekyler er det ikke særlig vigtigt at tænke over, hvor polar en binding er; Disse er meget kovalente, og fordelingen af deres elektriske ladninger (hvor de elektronrige eller fattige regioner er) tiltrækker mere opmærksomhed end at definere graden af kovalens af deres indre bindinger..
Imidlertid med diatomiske eller små molekyler sagde polariteten Eδ+-xδ- det er ret relativt.
Dette er ikke et problem med molekyler dannet mellem ikke-metalliske grundstoffer; Men når overgangsmetaller eller metalloider deltager, taler vi ikke længere kun om en polær kovalent binding, men om en kovalent binding med en vis ionisk karakter; og i tilfælde af overgangsmetaller med en kovalent koordineringsbinding givet sin art.
Eksempler på polær kovalent binding
CO
Den kovalente binding mellem kulstof og ilt er polær, fordi førstnævnte er mindre elektronegativ (χC = 2,55) end det andet (χELLER = 3,44). Derfor, når vi ser C-O, C = O eller C-O obligationer-, vi ved, at de er polære bindinger.
H-X
Hydrogenhalogenider, HX, er ideelle eksempler til forståelse af polær binding i dine diatomiske molekyler. At have elektronegativiteten af brint (χH = 2.2), kan vi estimere, hvor polære disse halogenider er over for hinanden:
-HF (H-F), χF (3.98) - χH (2.2) = 1,78
-HCI (H-Cl), χCl (3.16) - χH (2.2) = 0.96
-HBr (H-Br), χBr (2.96) - χH (2.2) = 0.76
-HI (H-I), χjeg (2.66) - χH (2.2) = 0.46
Bemærk, at ifølge disse beregninger er HF-bindingen den mest polære af alle. Hvad er dets ioniske karakter udtrykt i procent, er en anden sag. Dette resultat er ikke overraskende, fordi fluor er det mest elektronegative element af alle..
Da elektronegativiteten falder fra chlor til iod, bliver H-Cl-, H-Br- og H-I-bindingerne også mindre polære. H-I-bindingen skal være apolar, men den er faktisk polær og også meget "skør"; bryder let.
O-H
O-H-polarbindingen er måske den vigtigste af alle: takket være den eksisterer der liv, da det samarbejder med dipolmomentet i vand. Hvis vi estimerer forskellen mellem ilt og hydrogeners elektronegativiteter, har vi:
χELLER (3.44) - χH (2.2) = 1.24
Vandmolekylet, HtoEller du har to af disse obligationer, H-O-H. Dette og molekylens vinkelgeometri og dets asymmetri gør det til en meget polær forbindelse..
N-H
N-H-bindingen er til stede i aminogrupperne i proteiner. Gentagelse af den samme beregning, som vi har:
χN (3.04) - χH (2.2) = 0,84
Dette afspejler, at N-H-bindingen er mindre polær end O-H (1,24) og F-H (1,78).
Grim
Fe-O-bindingen er vigtig, fordi dens oxider findes i jernmineraler. Lad os se, om det er mere polært end H-O:
χELLER (3.44) - χTro (1,83) = 1,61
Derfor antages det med rette, at Fe-O-bindingen er mere polær end H-O (1,24) -binding; eller hvad er det samme som at sige: Fe-O har en større ionisk karakter end H-O.
Disse beregninger bruges til at finde ud af polaritetsgraderne mellem forskellige links; men de er ikke nok til at bestemme, om en forbindelse er ionisk, kovalent eller dens ioniske karakter.
Referencer
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Laura Nappi. (2019). Polære og ikke-polære kovalente obligationer: definitioner og eksempler. Undersøgelse. Gendannet fra: study.com
- Helmenstine, Anne Marie, Ph.D. (18. september 2019). Polar Bond Definition og eksempler (Polar Covalent Bond). Gendannet fra: thoughtco.com
- Elsevier B.V. (2019). Polær kovalent binding. ScienceDirect. Gendannet fra: sciencedirect.com
- Wikipedia. (2019). Kemisk polaritet. Gendannet fra: en.wikipedia.org
- Anonym. (5. juni 2019). Egenskaber ved polære kovalente obligationer. Kemi LibreTexts. Gendannet fra: chem.libretexts.org



Endnu ingen kommentarer