
Erythropoiesis faser og deres egenskaber, regulering, stimulanser
Det erytropoiesis Det er den proces, hvormed røde blodlegemer eller erytrocytter dannes. Disse blodlegemer hos mennesker har en gennemsnitlig levetid på 4 måneder og er ikke i stand til at reproducere sig selv. På grund af dette skal nye erytrocytter oprettes for at erstatte dem, der dør eller går tabt i blødninger..
Hos mænd er antallet af røde blodlegemer ca. 54 millioner pr. Milliliter, mens det hos kvinder er lidt mindre (48 millioner). Cirka 10 millioner erytrocytter går tabt dagligt, så et lignende beløb skal udskiftes.
Erythrocytter dannes af kerneholdige erythroblaster til stede i pattedyrs røde knoglemarv, mens de i andre hvirveldyr hovedsageligt produceres i nyrerne og milten.
Når de når slutningen af deres dage, fragmenterer de; derefter celler kaldet makrofager omfatter dem. Disse makrofager er til stede i leveren, rød knoglemarv og milt..
Når de røde blodlegemer destrueres, genbruges jernet til brug igen, mens resten af hæmoglobinet omdannes til et galdepigment kaldet bilirubin..
Erythropoiesis stimuleres af et hormon kaldet erythropoietin, men processen reguleres af forskellige faktorer, såsom temperatur, iltryk, blandt andre..
Artikelindeks
- 1 Stadier og deres egenskaber
- 1.1 1-sprængende kolonidannende enheder
- 1.2 2-Erythroid-kolonidannende celler
- 1.3 3-proerythroblaster
- 1.4 4-basofile erythroblaster
- 1,5 5-polykromatofile erythroblaster
- 1,6 7-reticulocytter
- 1.7 8-erytrocytter
- 2 Regulering af erythropoiesis
- 2.1 Oxygentryk
- 2.2 Testosteron
- 2.3 Temperatur
- 2.4 Parakrinregulering
- 3 Erythropoiesis-stimulerende midler
- 3.1 Kunstige ESA'er
- 4 Ineffektiv erythropoiesis
- 4.1 Mangler i nukleinsyresyntese
- 4.2 Mangler i syntesen af hæmgruppen
- 4.3 Mangler i globinsyntese
- 5 Referencer
Stadier og deres egenskaber
I voksne organismer forekommer erythropoiesis på specialiserede steder i den røde knoglemarv kaldet erythroblastiske øer. Til dannelsen af erytrocytter skal der forekomme flere processer, der spænder fra celleproliferation til modning af røde blodlegemer, der passerer gennem forskellige stadier af celledifferentiering..
Da celler gennemgår mitotiske opdelinger, reduceres deres størrelse og deres kerne såvel som kromatinkondensation og hæmoglobinisering. Derudover bevæger de sig væk fra oprindelsesområdet.
I de sidste stadier mister de kernen og andre organeller og vil komme i omløb og migrere gennem de cytoplasmatiske porer i endotelceller..
Nogle forfattere deler hele erythropoieseprocessen i to faser, den første af celleproliferation og differentiering; mens andre deler processen baseret på specifikke egenskaber ved cellen på hvert trin, når den observeres med Wrights plet. Baseret på sidstnævnte er stadierne af erythropoiesis:
1-Burst kolonidannende enheder
De er de første celler, der er følsomme over for erythropoietin, nogle forfattere kalder dem myeloide forfædre eller også BFU-E for dets akronym på engelsk. De er kendetegnet ved at udtrykke overfladeantigener såsom CD34 såvel som tilstedeværelsen af erythropoietinreceptorer i små mængder.
2-erythroid-kolonidannende celler
Forkortet på engelsk som CFU-E, de er i stand til at producere små kolonier af erythroblaster. Et andet kendetegn ved disse celler er, at mængderne af erythropoietinreceptorer er meget højere end i burst-kolonidannende enheder..
3-proerythroblaster
Betragtes som det første modningstrin af erytrocytter. De er karakteriseret ved deres store størrelse (14 til 19 µm ifølge nogle forfattere, op til 25 µm ifølge andre). Kernen er afrundet og præsenterer også nucleoli og rigelig kromatin.
Betragtes som det første modningstrin af erytrocytter. De er karakteriseret ved deres store størrelse (14 til 19 µm ifølge nogle forfattere, op til 25 µm ifølge andre). Kernen er stor, afrundet med kromatin arrangeret i form af filamenter og 2 eller 3 nucleoli.
Optagelse af plasmajern begynder på dette stadium. De har en halveringstid på 20 timer for at vige gennem mitose til næste trin.
4-basofile erythroblaster
Også kaldet normoblaster, de er mindre end deres forløbere. Disse celler pletter blå med vital farvning, det vil sige de er basofile. Kernen er kondenseret, nucleoli er forsvundet, og de har et stort antal ribosomer. På dette stadium begynder syntesen af hæmoglobin.
I begyndelsen er de kendt som Type I basofile erythroblaster, og efter en mitotisk opdeling transformeres de til Type II, som forbliver basofile og præsenterer større hæmoglobinsyntese. Den omtrentlige varighed af begge celler sammen svarer til proerythroblaster.
5-polykromatofile erythroblaster
De dannes ved mitotisk opdeling af basofile erythroblaster af type II og er de sidste celler, der er i stand til at dividere ved mitose. Deres størrelse varierer fra 8 til 12 µm, og de har en afrundet og kondenseret kerne.
Cytoplasmaet i disse celler pletter fører grå med Wrights plet. Har en høj koncentration af hæmoglobin, og antallet af ribosomer er fortsat højt.
6-ortokromatiske erythroblaster
Farven på disse celler er lyserød eller rød på grund af mængden af hæmoglobin, de har. Dens størrelse er lidt mindre end dens forløbere (7 til 10 µm), og den har en lille kerne, som vil blive udvist af exocytose, når cellerne modnes..
7-reticulocytter
De dannes ved differentiering af ortokrome erythroblaster, mister organeller og fylder deres cytoplasma med hæmoglobin. De forbliver i den røde knoglemarv i to til tre dage, indtil de migrerer til blodet, hvor de vil fuldføre deres modning..
8-erytrocytter
De er de modne dannede grundstoffer, det endelige produkt af erythropoiesis, og som dannes ved modning af reticulocytter. De har en bikonkav form på grund af fraværet af en kerne og interaktionen mellem erytrocytens cytoskelet og to proteiner kaldet spectrin og actin.
De er de mest rigelige blodlegemer, de er dannet af reticulocytter. Hos pattedyr har de en bikonkav form på grund af fraværet af en kerne og interaktionen mellem erytrocytens cytoskelet og to proteiner kaldet spectrin og actin. I andre hvirveldyr er de afrundede og bevarer kernen.
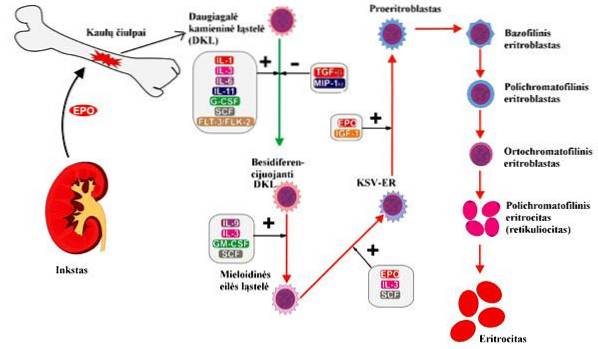
Regulering af erythropoiesis
Selvom erythropoietin stimulerer dannelsen af røde blodlegemer for at forbedre blodets iltbærende kapacitet, er der flere grundlæggende mekanismer til at regulere denne formation, herunder:
Oxygentryk
Oxygenkoncentrationen i blodet regulerer erythropoiesis. Når denne koncentration er meget lav i blodgennemstrømningen til nyrerne, stimuleres produktionen af røde blodlegemer..
Denne lave koncentration af væv O2 kan forekomme på grund af hypoxæmi, anæmi, renal iskæmi, eller når affiniteten af hæmoglobin til denne gas er højere end normalt..
Miescher var i 1893 den første til at antyde forholdet mellem vævshypoxi og erythropoiesis. Imidlertid stimulerer denne hypoxi ikke direkte knoglemarven til at producere røde blodlegemer, som Miescher foreslog. Tværtimod inducerer det nyrerne til at producere hormonet erythropoietin.
Produktion af erytropoietin på grund af vævshypoxi er genetisk reguleret, og de receptorer, der opdager sådan hypoxi, findes i nyrerne. Produktion af erytropoietin øges også på grund af et fald i vævets iltpartialtryk efter blødning..
Cellerne, der fremstiller erythropoietin, findes i nyrerne og leveren. Stigningen i produktionen af dette hormon under anæmi skyldes en stigning i antallet af celler, der producerer det..
Testosteron
Testosteron regulerer indirekte erythropoiesis ved at regulere jernniveauer i blodet. Dette hormon virker direkte på virkningen af et cytoplasmatisk protein kaldet BMP-Smad (knoglemorfogenetisk protein-Smad) i hepatocytter..
På grund af virkningen af testosteron undertrykkes hepcidin-transkription. Dette hepcidin forhindrer passage af jern fra celler til plasma fra makrofager, der genbruger jern, hvilket fører til et drastisk fald i blodjern.
Når hypoferræmi opstår, vil der være en hæmning af erythropoietin, da der ikke vil være noget jern til produktion af erythrocytter..
Temperatur
Temperatur har vist sig at have en effekt på erythripoiesis. Eksponering for meget lave temperaturer medfører behovet for at producere varme i stofferne.
Dette kræver forøgelse af antallet af erytrocytter for at tilføre ilt til perifere væv. Det er imidlertid ikke helt klart, hvordan denne type regulering opstår..
Parakrin regulering
Der er tilsyneladende en produktion af erythropoietin af neuronerne i centralnervesystemet for at beskytte sig mod iskæmisk skade og apoptose. Forskere har dog ikke været i stand til at bekræfte det endnu..
Erythropoiesis stimulerende midler
Erythropoiesis-stimulerende midler (ESA'er) er stoffer, der er ansvarlige for at stimulere produktionen af erytrocytter. Erythropoietin er det hormon, der er naturligt ansvarlig for denne proces, men der er også syntetiske produkter med lignende egenskaber.
Erythropoietin er et hormon, der hovedsageligt syntetiseres i nyrerne. I de tidlige stadier af udviklingen er leveren også involveret i den aktive produktion af erythropoietin. Når udviklingen fortsætter, har sidstnævnte organ imidlertid mindre involvering i processen..
Erytrocyten begynder at sprede receptorer for erythropoietin på membranoverfladen. Erythropoietin aktiverer en række intercellulære signaltransduktionskaskader, der oprindeligt producerer hæmoglobinsyntese og får reticulocytter til at handle hurtigere og frigives i kredsløbet..
Kunstige ESA'er
Kunstige ESA'er klassificeres i generationer (første til tredje) afhængigt af datoen for oprettelse og markedsføring. Strukturelt og funktionelt svarende til erythropoietin.
Første generations ESA'er er kendt som epoetin alfa, beta og delta. De første to produceres ved rekombination fra dyreceller og har en halveringstid på ca. 8 timer i kroppen. Epoetin delta er i mellemtiden syntetiseret fra humane celler.
Darbepoetin alfa er en anden generation af ESA, produceret af kinesiske hamsterceller ved hjælp af teknologi kaldet rekombinant DNA. Den har en halveringstid mere end tre gange længere end første generation af ESA'er. Som med epoetiner har nogle højtydende atleter brugt darbepoetin som et middel til doping.
Continuous Erythropoetin Receptor Activator, eller CERA for dets akronym på engelsk, er det generiske navn for tredje generation af ESA'er. De forsøger ikke at simulere strukturen og funktionen af erythropoietin, men handler snarere ved at stimulere receptoren for erythropoietin og dermed øge dens virkning..
Halveringstiden er adskillige uger i stedet for timer, ligesom de tidligere stoffer. Brugt kommercielt siden 2008, men dets ulovlige anvendelse i sportsaktiviteter går tilsyneladende tilbage to eller tre år før dets lovlige kommercialisering.
Ineffektiv erythropoiesis
Ineffektiv eller ineffektiv erythropoiesis opstår, når de dannede røde blodlegemer er defekte og normalt ødelægges før eller kort efter at have forladt knoglemarven..
Ineffektiv erythropoiesis kan skyldes defekter i syntesen af nukleinsyrer, hæmgruppen eller globinerne. Disse defekter forårsager forskellige typer anæmi.
Defekter i nukleinsyresyntese
I dette tilfælde er der en mangel på folsyre og cobalamin, DNA-syntese hæmmes i kernen i erytrocytpromotorcellerne, så de ikke er i stand til at dele mitotisk. Cytoplasmaet øger på sin side dets volumen (makrocytose) med oprindelse i en stor celle kaldet megaloblast.
I disse tilfælde stammer en række anæmi kaldet megaloblastiske anæmi, hvoraf den mest almindelige er perniciøs anæmi. I denne sygdom er der ingen absorption af vitamin B12 i tyndtarmen.
Andre årsager til megaloblastisk anæmi inkluderer fordøjelsessygdomme, malabsorption, folinsyre-mangel og på grund af visse lægemidler.
Symptomer på denne type anæmi inkluderer unormal bleghed, irritabilitet, appetitløshed, diarré, gangbesvær eller muskelsvaghed. Afhængig af årsagen kan det behandles med vitamin- eller folinsyretilskud..
Mangler i syntesen af hæmgruppen
Ineffektiv erythropoiesis på grund af mangel på jernsyntese kan forårsage to typer anæmi; jernmangel mikrocytisk anæmi og sideroblastisk anæmi.
Mikrocytisk anæmi er kendt som en gruppe af anæmi, der er karakteriseret ved små og bleg røde blodlegemer, de kan have forskellige oprindelser, herunder thalassæmi og ineffektiv erythropoiesis.
Jern- og hæmosiderinniveauer er meget høje i sideroblastisk anæmi. Hæmosiderin er et gult pigment afledt af hæmoglobin og vises, når niveauerne af metallet er højere end normalt. Denne type anæmi forårsager basofils død i den røde knoglemarv, og der er ingen syntese af hæmoglobin.
Det kaldes sideroblastisk anæmi, fordi erythrocytter udvikler sig unormalt på grund af ophobning af jern i form af granuler, der modtager navnet sideroblaster. Sideroblastisk anæmi kan være medfødt eller være sekundær og have forskellige årsager.
Mangler i globinsyntese
I dette tilfælde forekommer seglcelleanæmi og beta-thalassæmi. Seglcelleanæmi er også kendt som seglcelleanæmi. Det produceres ved en genetisk mutation, der fører til substitution af glutaminsyre med valin under syntesen af beta-globin.
På grund af denne substitution aftager affiniteten af hæmoglobin til ilt, og der er atrofi af erytrocyten, hvilket får en seglform i stedet for den normale bikoncave skiveform. Patienten med seglcelleanæmi er modtagelig for mikroinfarkt og hæmolyse.
Thalassæmi er en sygdom forårsaget af utilstrækkelig genetisk kodning af α- og β-globiner, der fører til en tidlig død af erytrocyten. Der er omkring hundrede forskellige mutationer, der kan forårsage thalassæmi med forskellige sværhedsgrader.
Referencer
- Erithropoiesis. På Wikipedia. Gendannet fra en.wikipedia.org.
- J.P. Labbrozzi (2015). Produktion af erytrocytter fra CD34-celler+ navlestrengsblod. Doktorafhandling. Autonome Universitet i Barcelona. Spanien.
- H. Parrales (2018). Fysiologi af erythropoiesis. Gendannet fra cerebromedico.com.
- Anæmi. På Wikipedia. Gendannet fra en.wikipedia.org.
- Erithropoiesis stimulerende middel. På Wikipedia. Gendannet fra en.wikipedia.org.
- Ineffektiv erithropoiesis. På Wikipedia. Gendannet fra en.wikipedia.org.



Endnu ingen kommentarer