
Aluminiumphosphid (AIP) struktur, egenskaber, anvendelser, risici
Det aluminiumphosphid Det er en uorganisk forbindelse dannet af et aluminiumatom (Al) og et phosphoratom (P). Dens kemiske formel er AlP. Det er en solid mørkegrå eller, hvis meget ren, gul. Det er en ekstremt giftig forbindelse for levende væsener.
Aluminiumphosphid reagerer med fugt til dannelse af phosphin eller phosphan PH3, som er en giftig gas. Af denne grund må AlP ikke komme i kontakt med vand. Reagerer stærkt med syrer og alkaliske opløsninger.

Det blev tidligere brugt til at eliminere skadedyr som insekter og gnavere på steder, hvor korn og andre landbrugsprodukter blev opbevaret. På grund af sin høje fare er det dog forbudt i de fleste lande i verden..
I øjeblikket undersøges dets anvendelighed inden for elektronikområdet teoretisk ved hjælp af computere, der beregner muligheden for at få halvleder-AlP-nanorør, dvs. ekstremt små rør, der kun kan transmittere elektricitet under visse betingelser..
Aluminiumphosphid er en meget farlig forbindelse. Det skal håndteres med sikkerhedsredskaber som handsker, briller, åndedrætsværn og beskyttelsesdragt..
Artikelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 egenskaber
- 3.1 Fysisk tilstand
- 3.2 Molekylvægt
- 3.3 Smeltepunkt
- 3.4 Tæthed
- 3.5 Opløselighed
- 3.6 Kemiske egenskaber
- 3.7 Andre egenskaber
- 4 Opnåelse
- 5 anvendelser
- 5.1 Ved eliminering af skadedyr (ophørt anvendelse)
- 5.2 I andre applikationer
- 6 Teoretisk undersøgelse af AlP-nanorør
- 6.1 AlP-nanorør med bor
- 6.2 AlP-nanorør med ændret struktur
- 7 risici
- 8 Referencer
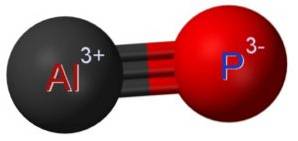
Struktur
Aluminiumphosphidet AlP dannes ved foreningen af et aluminiumatom Al og et phosphoratom P. Bindingen mellem begge er kovalent og tredobbelt, derfor er den meget stærk.
Aluminium i AlP har en oxidationstilstand på +3 og fosfor har en valens på -3.
Nomenklatur
- Aluminiumphosphid
Ejendomme
Fysisk tilstand
Mørkegrå eller mørkegul eller grøn krystallinsk fast stof. Kubiske krystaller.
Molekylær vægt
57,9553 g / mol
Smeltepunkt
2550 ºC
Massefylde
2,40 g / cm3 ved 25 ° C
Opløselighed
Nedbrydes i vand.
Kemiske egenskaber
Reagerer med fugt for at give phosphin eller phosphan PH3 som er en brandfarlig og giftig forbindelse. Fosfin eller phosphan antænder spontant ved kontakt med luft, undtagen hvis der er overskydende vand.
Reaktionen af aluminiumphosphid med vand er som følger:
Aluminiumphosphid + vand → Aluminiumhydroxid + phosphin
AlP + 3 HtoO → Al (OH)3 + PH3↑
De kommercielle præsentationer har aluminiumcarbonat Alto(CO3)3 for at forhindre fosfin selvantændelse, der opstår, når AlP kommer i kontakt med fugt i luften.
AlP er stabil, når den er tør. Reagerer voldsomt med syrer og alkaliske opløsninger.
Aluminiumphosphid AlP smelter ikke, sublimer eller nedbrydes ikke termisk ved temperaturer så høje som 1000 ° C. Selv ved denne temperatur er dets damptryk meget lavt, dvs. det fordamper ikke ved denne temperatur..
Når det opvarmes til nedbrydning, udsender det giftige fosforoxider. I kontakt med metaller kan det afgive brændbare brintgasser Hto.
Andre egenskaber
Når den er ren, viser den en gullig farve, når den blandes med rester af præparationsreaktionen, giver den en farve fra grå til sort..
Dens lave flygtighed udelukker det fra at have nogen lugt, så hvidløgslugt, som det undertiden udsender, skyldes fosfin PH3 der dannes i nærvær af fugt.
Opnåelse
Aluminiumphosphid kan opnås ved opvarmning af en blanding af pulveriseret aluminiummetal (Al) og det røde phosphor (P) -element.
På grund af affiniteten af fosfor (P) til ilt (Oto) og aluminium (Al) med ilt og nitrogen (Nto), skal reaktionen udføres i en atmosfære fri for disse gasser, for eksempel i en atmosfære af brint (Hto) eller naturgas.
Reaktionen startes ved hurtig opvarmning af en zone af blandingen, indtil reaktionen starter, som er eksoterm (varme produceres under reaktionen). Fra det øjeblik går reaktionen hurtigt.
Aluminium + fosfor → Aluminiumfosfid
4 Al + P4 → 4 AlP
Ansøgninger
I skadedyrsbekæmpelse (ophørt anvendelse)
Aluminiumphosphid blev tidligere brugt som et insekticid og som en gnaverdræber. Men selvom det er blevet forbudt på grund af dets toksicitet, bruges det stadig i nogle dele af verden..
Det bruges til gasning i lukkede rum, hvor der er forarbejdede eller uforarbejdede landbrugsfødevarer (såsom korn), dyrefoder og ikke-fødevareprodukter.
Målet er at kontrollere insekter og gnavere, der angriber lagrede genstande, hvad enten de er spiselige eller ej..
Det gør det muligt at kontrollere gnavere og insekter i ikke-husholdnings-, landbrugs- eller ikke-landbrugsområder, sprøjtning udendørs eller i deres huler og reder for at forhindre dem i at overføre visse sygdomme.


Dens anvendelsesform består i at udsætte AlP for luft eller fugtighed, da phosphin eller phosphan PH frigøres.3 der skader mange organer i skadedyret, der skal elimineres.

I andre applikationer
Aluminiumphosphid AlP anvendes som en kilde til phosphin eller phosphan PH3 og bruges i halvlederforskning.
Teoretisk undersøgelse af AlP-nanorør
Teoretiske undersøgelser er blevet udført på dannelsen af aluminiumphosphid AlP-nanorør. Nanorør er meget små og meget tynde cylindre, der kun kan ses med et elektronmikroskop..
AlP-nanorør med bor
Teoretiske undersøgelser udført gennem beregningsberegninger viser, at de urenheder, der kunne føjes til AlP-nanorørene, kunne ændre de teoretiske egenskaber ved disse.
For eksempel anslås det, at tilføjelse af bor (B) -atomer til AlP-nanorør kan gøre dem til halvledertype-s. En halvleder er et materiale, der opfører sig som en leder af elektricitet eller som en isolator afhængigt af det elektriske felt, som det udsættes for.
Og en halvleder type-s Dette er, når urenheder tilsættes til materialet, i dette tilfælde er AlP udgangsmaterialet, og boratomer ville være urenhederne. Halvledere er nyttige til elektronikapplikationer.
AlP-nanorør med ændret struktur
Nogle forskere har udført beregninger for at bestemme effekten af at ændre krystalgitterstrukturen af AlP-nanorør fra sekskantet til oktaedrisk..
De fandt ud af, at manipulation af gitterstrukturen kunne bruges til at finjustere ledningsevnen og reaktiviteten af AlP-nanorør og designe dem til at være nyttige til elektronik- og optikapplikationer..
Risici
Kontakt med aluminiumfosfid kan irritere hud, øjne og slimhinder. Ved indtagelse eller indånding er det giftigt. Kan absorberes gennem huden med toksiske virkninger.
Hvis AlP kommer i kontakt med vand, reagerer det og danner phosphin eller phosphan PH3 som er ekstremt brandfarlig, da den antænder i kontakt med luft. Derfor kan det eksplodere. Derudover forårsager fosfin mennesker og dyrs død.
Da aluminiumfosfid er et billigt pesticid, er dets anvendelse en almindelig årsag til forgiftning hos mennesker og bærer en høj dødelighed.

Det reagerer med luftfugtigheden i slimhinderne og med saltsyre HCI i maven og danner den meget giftige phosphangas PH3. Derfor dannes fosfin ved indånding og indtagelse i kroppen med fatale virkninger..
Indtagelsen forårsager blødning i mave-tarmkanalen, hjerte-kar-kollaps, neuropsykiatriske lidelser, åndedræts- og nyresvigt inden for få timer..
AlP er meget giftigt for alle landdyr og vanddyr.
Referencer
- OS. National Library of Medicine. (2019). Aluminiumphosphid. Gendannet fra pubchem.ncbi.nlm.nih.gov.
- Sjögren, B. et al. (2007). Aluminium. Andre aluminiumforbindelser. I håndbog om toksikologi af metaller (tredje udgave). Gendannet fra sciencedirect.com.
- Gupta, R.C. og Crissman, J.W. (2013). Sikkerhedsvurdering inklusive aktuelle og nye problemer inden for toksikologisk patologi. Menneskelig risiko. I Haschek og Rousseauxs håndbog om toksikologi patologi (tredje udgave). Gendannet fra sciencedirect.com.
- White, W.E. og Bushey, A.H. (1944). Aluminiumphosphid - forberedelse og sammensætning. Journal of The American Chemical Society 1944, 66, 10, 1666-1672. Gendannet fra pubs.acs.org.
- Mirzaei, Maryam og Mirzaei, Mahmoud. (2011). En teoretisk undersøgelse af bor-dopet aluminiumphosphid-nanorør. Computational and Theoretical Chemistry 963 (2011) 294-297. Gendannet fra sciencedirect.com.
- Takahashi, L. og Takahashi, K. (2018). Tuning af den elektroniske struktur af et aluminiumphosphid-nanorør gennem konfiguration af gittergeometrien. ACS-appl. Nano Mater. 2018, 1, 501-504. Gendannet fra pubs.acs.org.
- Gupta, P.K. (2016). Toksiske virkninger af pesticider (landbrugskemikalier). Aluminiumphosphid. I grundlæggende toksikologi. Gendannet fra sciencedirect.com.



Endnu ingen kommentarer