
Kondenseret formel hvad det er og eksempler (metan, ethan, glukose ...)
Det kondenseret formel det er en rent tekstlig repræsentation af et molekyle, hvor linkene udelades. Dens formål er at tillade at vide, hvad der er rækkefølgen af atomerne. Generelt har lineære eller forgrenede molekyler kondenserede formler, bortset fra cykliske eller forgrenede..
I organisk kemi er der ofte forvirring om, hvad der er forskellen mellem denne formel og den molekylære. Faktisk er det almindeligt at finde dem som synonymer. I mellemtiden anvendes i uorganisk kemi molekylære formler mere, da de i de fleste tilfælde nøjagtigt beskriver kovalente forbindelser; som vand, HtoELLER.
Artikelindeks
- 1 Hvad er den kondenserede formel?
- 2 Eksempler
- 2.1 Metan
- 2.2 Ethan
- 2.3 Glukose og fruktose
- 2.4 Butan
- 2,5 Ethanol
- 2.6 Pentan
- 2.7 Octan
- 2.8 Cyclohexan
- 2.9 Aceton
- 2.10 Eddikesyre
- 3 Generel kommentar
- 4 Referencer
Hvad er den kondenserede formel?
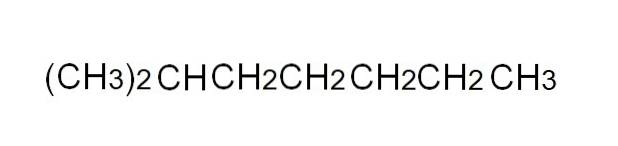
For at definere det mere bekvemt er den kondenserede formel en forenklet gengivelse af den halvekspanderede. Det er ikke nødvendigt at skrive enkelte links, og det skal heller ikke strække sig over mere end en linje i en tekst. For eksempel kan 2-methylheptan, en forgrenet alkan, repræsenteres i samme linje som i billedet ovenfor.
Kondenserede formler er nyttige til at repræsentere nogle molekyler uden at skulle tegne dem. Dette er fremragende, når man skriver kemiske ligninger, hvor stærkt forgrenede eller cykliske molekyler ikke er involveret. Det vil ses, at disse formler bruger parenteser til yderligere at forenkle repræsentationen af et molekyle.
Eksempler
Metan
Methan er den eneste kemiske forbindelse, der har en enkelt formel: CH4. Dette svarer til det empiriske, molekylære, kondenserede og halvudviklede på samme tid. Derfor foretrækker folk mange gange at henvise enkelt og upræcist til den 'kemiske formel' af en forbindelse for at undgå forveksling mellem alle disse begreber..
Ethan
Ethan har molekylformlen CtoH6. Den kondenserede formel er i stedet CH3CH3. Bemærk, at C-C-obligationen og C-H-obligationen er udeladt. Ideen er at være i stand til at skrive formlen som om det var et ”ord” uden at skulle tegne streger eller tegne strukturer.
Per definition er molekylformlen CtoH6 og ikke CH3CH3; Imidlertid bruges begge formler til enkle molekyler til at udveksle, selvom det stadig er forkert. Dette er et uoverensstemmelsespunkt mellem forskellige kilder, hvor der tilsyneladende ikke er nogen specifikke regler i denne henseende..
Glukose og fruktose
Her er et eksempel, hvor der straks observeres en fejl, når man ønsker at udveksle molekylformlen med den kondenserede.
Det søde par, glucose og fruktose, har den samme molekylformel: C6H12ELLER6, og derfor tjener dette ikke til at differentiere dem. I modsætning hertil fastslår de strukturelle og semi-udviklede formler visuelt, at de er forskellige molekyler.
Imidlertid har hverken glucose eller fruktose en kondenseret formel. Dette skyldes, at uanset hvad deres repræsentation eller projektion er, kan deres strukturer ikke skrives på samme linje; eller i det mindste på en måde, der er behagelig og enkel i læsernes øjne.
Butan
Butan har molekylformlen C4H10. Den har to isomerer: den lineære, n-butan og den forgrenede 2-methylpropan. Begge kan repræsenteres af deres kondenserede formler. Det n-butan er CH3CHtoCHtoCH3 eller CH3(CHto)toCH3, og 2-methylpropan er CH3CH (CH3)to eller (CH3)3CH.
I 2-methylpropan har vi en CH-gruppe omgivet af tre CH3. Dens to formler er gyldige, og parenteser bruges til at fremhæve grenene, hvor abonnementet er en indikator for, hvor mange grupper der udgør nævnte gren.
Ethanol
Ethanol har den kondenserede formel CH3CHtoOH. Bemærk, hvor tæt det ligner sin semi-udviklede formel: CH3-CHto-OH. Det samme gøres med propanol, CH3CHtoCHtoÅh n-butanol, CH3CHtoCHtoCHtoOH og med alle andre alkoholer.
Hvis de har en gren, vil det blive angivet inden for en parentes til højre for det atom, som det er knyttet til. For eksempel kunne 2-methylbutanol skrives som: CH3CHtoCH (CH3CHtoOH. Bemærk, at det for mange molekyler bliver mere praktisk at ty til en strukturel eller semi-udviklet formel.
Pentan
Den lineære isomer af pentan, n-pentan, er det let at repræsentere ved dens kondenserede formel: CH3CHtoCHtoCHtoCH3. Denne formel kan også forenkles ved hjælp af parenteser: CH3(CHto)3CH3, hvilket indikerer, at mellem de to CH3 der er tre CHto.
De to andre isomerer af pentan er dog lidt mere komplicerede: CH3CHtoCH (CH3)to, for 2-methylbutan og C (CH3)4 for 2,2-dimethylpropan eller neopentan. Bemærk, at kulstofatomet til venstre for parentesen er det, der danner bindinger med substituenterne eller grenene..
Octane
Den lineære isomer af oktan, n-octan på grund af dets længde er det nu hensigtsmæssigt at repræsentere dens kondenserede formel som CH3(CHto)6CH3. Det er på dette tidspunkt, at noget skal være klart med kondenserede formler: de søger at spare tid, når de repræsenterer molekyler eller forbindelser, uden at skulle skrive så meget på papir.
Cyclohexan
Tilfældet med cyclohexan svarer til tilfældet med glucose og fruktose: det mangler formelt en kondenseret formel, fordi det er en cyklisk forbindelse. En måde at forsøge at repræsentere det på ville være: (CHto)6, hvilket antyder, at seks CH-grupperto skal være forbundet, da det kun er muligt, hvis de er lukket i en sekskantet ring. Det er dog bedre at tegne ringen.
Aceton
Aceton har den særlige egenskab at have en carbonylgruppe, C = O. Derfor har vi tre muligheder for at skrive dens kondenserede formel: (CH3)toCO, CH3C (O) CH3 eller CH3(C = O) CH3.
I større molekyler repræsenteres carbonylgruppen normalt som (O) under hensyntagen til, at carbonatomet til venstre er det, der danner dobbeltbindingen med ilt, C = O.
Eddikesyre
Den kondenserede formel for eddikesyre er CH3COOH eller CH3COtoH. Et vigtigt punkt kommer her frem: funktionelle grupper skrevet på samme linje er dele af en kondenseret formel. Dette var tilfældet med ethanol og acetone og gælder også for thioler (-SH), aldehyder (-CHO), estere (-COtoR eller -COOR) og aminer (-NHto).
Generel kommentar
Der er en masse forvirring mellem molekylære og kondenserede formler. Måske skyldes det, at disse repræsentationer alene allerede giver et groft billede af molekylet, hvorfor vi tror, det er molekylformlen.
Ligeledes er formler som C6H12ELLER6 de betragtes også som kondenserede, fordi det i dem er forenklet, at molekylet "kondenseres" til atomer og abonnementer. Derfor er det almindeligt at se, hvordan de to formler nævnes som om de var synonymer.
I mange kilder, herunder Wikipedia-artikler, bruges udtrykkene 'kemisk formel' til at henvise til molekylæret (type C6H12ELLER6 og andre) og 'formel' for at henvise til det kondenserede.
Referencer
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Helmenstine, Anne Marie, Ph.D. (18. november 2019). Kondenseret formeldefinition i kemi. Gendannet fra: thoughtco.com
- James Ashenhurst. (11. december 2019). Kondenserede formler: Dechiffrere hvad parenteserne betyder. Master organisk kemi. Gendannet fra: masterorganicchemistry.com
- Co-engineering. (2. maj 2016). Empirisk, strukturel og kondenseret formel. Gendannet fra: quimiotecablog.wordpress.com
- Introduktion til kemi: generelt, organisk og biologisk. (s.f.). Kondenserede strukturelle og linjevinklede formler. Gendannet fra: 2012books.lardbucket.org

Endnu ingen kommentarer