
Alkylhalogenidegenskaber, fremstilling, eksempler

Det alkylhalogenider er organiske forbindelser, hvori et carbonatom med sp-hybridisering3 er kovalent bundet til et halogen (F, Cl, Br, I). Fra et andet perspektiv er det praktisk at forenkle at antage, at de er haloalkaner; disse er alkaner, hvortil nogle H-atomer er blevet erstattet med halogenatomer.
Som navnet antyder, skal halogenatomer også være bundet til alkylgrupper, R, for at blive betragtet som denne type halogenid; skønt de strukturelt kan være substituerede eller forgrenede og have aromatiske ringe og stadig forblive et alkylhalogenid.
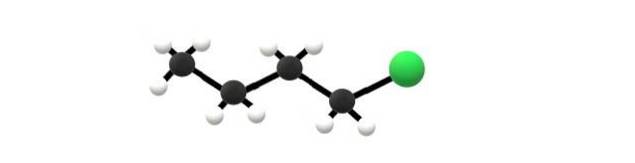
Ovenfor er 1-chlorbutanmolekylet, hvilket svarer til et af de enkleste alkylhalogenider. Det kan ses, at alle dets carbonatomer har enkeltbindinger og også har SP-hybridisering3. Derfor er den grønne kugle, der svarer til Cl-atomet, forbundet med et skelet afledt af alkanbutan.
Endnu enklere eksempler end 1-chlorbutan er dem, der stammer fra methangas: det mindste carbonhydrid af alle.
Fra dets molekyle af CH4 H-atomer kan erstattes af f.eks. Jod. Hvis en H er substitueret, har vi CH3I (iodomethan eller methyliodid). Ved at erstatte to H får vi CHtojegto (diiodomethan eller methyleniodid). Derefter og endelig erstatter jeg'erne alle H'erne ved at give CHI3 (iodform) og CI4 (carbontetraiodid).
Alkylhalogenider er kendetegnet ved at være meget reaktive, og ved at have de mest elektronegative atomer i det periodiske system er det intuiteret, at de gennem uendelige mekanismer påvirker biologiske matricer.
Artikelindeks
- 1 Egenskaber for alkylhalogenider
- 1.1 Kogepunkter og smeltepunkter
- 1.2 Polaritet
- 1.3 Opløsningsmiddelkraft
- 2 Nomenklatur
- 2.1 Eksempel
- 3 Opnåelse
- 3.1 Halogenering med lys eller ultraviolet stråling
- 3.2 Tilsætning af hydrocider eller halogener til alkener
- 4 Reaktioner
- 4.1 Nukleofil substitution
- 4.2 Bortskaffelse
- 4.3 Syntese af Grignard-reagenser
- 5 eksempler
- 6 anvendelser
- 6.1 Opløsningsmiddel
- 6.2 Organisk syntese
- 6.3 Farmaceutisk industri
- 6.4 Kølemidler
- 7 Referencer
Egenskaber af alkylhalogenider
Egenskaberne for denne familie af forbindelser afhænger af deres molekylære strukturer. Sammenlignet med dem af dets afledte alkaner kan der dog observeres bemærkelsesværdige forskelle forårsaget af det enkle faktum at have C-X-bindinger (X = halogenatom).
Det vil sige, at C-X-bindingerne er ansvarlige for enhver forskel eller lighed mellem et eller flere alkylhalogenider..
Til at begynde med er CH-bindingerne næsten apolare, givet den lille elektronegativitetsforskel mellem C og H; på den anden side udgør C-X-bindingerne et permanent dipolmoment på grund af det faktum, at halogener er mere elektronegative end kulstof (især fluor).
På den anden side er nogle halogener lette (F og Cl), mens andre er tunge (Br og I). Deres atommasser former også forskelle inden for C-X-bindingerne; og til gengæld direkte på halogenidets egenskaber.
Derfor er tilsætning af halogener til et carbonhydrid lig med at øge dets polaritet og molekylvægt; svarer til at gøre det mindre flygtigt (op til et punkt), mindre brandfarligt og øge dets kogepunkter eller smeltepunkter.
Kogepunkter og smeltepunkter
Når det er sagt ovenfor, vises størrelsen og derfor vægten af de forskellige halogener i stigende rækkefølge:
F < Cl < Br < I
Således kan alkylhalogenider indeholdende F-atomer forventes at være lettere end dem, der indeholder Br- eller I-atomer..
For eksempel betragtes nogle halogenider afledt af methan:
CH3F < CH3Cl < CH3Br < CH3jeg
CHtoFto < CHtoClto < CHtoBrto < CHtojegto
Og så videre for de andre afledte produkter med en højere grad af halogenering. Bemærk, at rækkefølgen opretholdes: fluorhalogenider er lettere end jodhalogenider. Ikke kun det, men også deres kogepunkter og smeltepunkter adlyder også denne ordre; RF koger ved lavere temperaturer end RI (R = CH3, i denne sag).
Ligeledes er alle disse væsker farveløse, da elektroner ikke kan absorbere eller frigive fotoner i deres C-X-bindinger for at transitere andre energiniveauer. Efterhånden som de bliver tungere, kan de imidlertid krystallisere og vise farver (det samme gør ioform, CHI3).
Polaritet
C-X obligationer adskiller sig i polaritet, men i omvendt rækkefølge som ovenfor:
C-F> C-Cl> C-Br> C-I
Derfor er CF-obligationer mere polære end C-I-obligationer. At være mere polære, har RF-halogenider en tendens til at interagere gennem dipol-dipolkræfter. I mellemtiden er deres dipolmomenter svagere i RBr- eller RI-halogenider, og interaktionerne styret af Londons dispersionsstyrker får større styrke..
Opløsningsmiddelkraft
Da alkylhalogeniderne er mere polære end de alkaner, hvorfra de stammer, øger de deres evne til at opløse et større antal organiske forbindelser. Det er af denne grund, at de har tendens til at være bedre opløsningsmidler; skønt det ikke betyder, at de kan erstatte alkaner i alle applikationer.
Der er tekniske, økonomiske, økologiske og ydelseskriterier, der foretrækker et halogeneret opløsningsmiddel frem for en alkan.
Nomenklatur
Der er to måder at navngive et alkylhalogenid: ved dets almindelige navn eller ved dets systematiske navn (IUPAC). Almindelige navne er normalt mere bekvemme at bruge, når RX er enkel:
CHCl3
Kloroform: almindeligt navn
Methyltrichlorid eller trichlormethan: IUPAC-navn.
Men systematiske navne foretrækkes (og den eneste mulighed), når du har forgrenede strukturer. Ironisk nok er almindelige navne nyttige igen, når strukturer er for komplicerede (som dem, der ses i sidste afsnit).
Reglerne for navngivning af en forbindelse i henhold til IUPAC-systemet er de samme som for alkoholer: hovedkæden identificeres, som er den længste eller den mest forgrenede. Derefter er kulstofferne opført startende fra slutningen tættest på substituenterne eller grenene, navngivet i alfabetisk rækkefølge.
Eksempel
For at illustrere det har vi følgende eksempel:
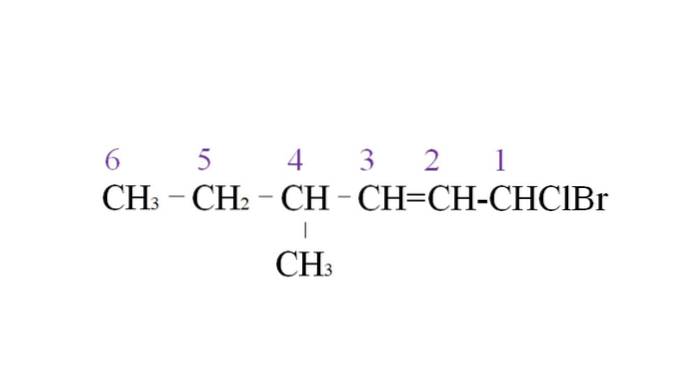
Den første gren er methylgruppen ved C-4; men da der er en dobbelt obligation, får den højere prioritet i forhold til den angivne regel. Af denne grund begynder den længste kæde at blive opført fra højre med et kulstofatom bundet til to halogener: Cl og Br.
Med optællingen navngives substituenterne i alfabetisk rækkefølge:
1-brom-1-chlor-4-methyl-2-hexen.
Opnåelse
For at opnå alkylhalogeniderne skal molekylerne underkastes en halogeneringsproces; inkorporere halogenatomer i deres strukturer, især et atom med en carbon sp3.
Der er to metoder til at opnå eller syntetisere dem: ved ultraviolet stråling gennem en fri radikalmekanisme eller ved tilsætning af hydrocider eller halogener..
Halogenering med lys eller ultraviolet stråling
Den første, den mindst passende og med den dårligste ydeevne, består i at bestråle alkanerne med ultraviolet stråling (hv) i nærværelse af et halogen. For eksempel er ligningerne for chlorering af methan vist:
CH4 + Clto => CH3Cl + HCI (under UV-lys)
CH3Cl + Clto => CHtoClto + HCI
CHtoClto + Clto => CHCl3 + HCI
CHCl3 + Clto => CCl4 + HCI
De fire forbindelser (CH3Cl, CHtoClto, CHCl3 og CCl4) dannes, og derfor har du en blanding, der kan udsættes for fraktioneret destillation. Denne metode er imidlertid upraktisk, og det foretrækkes at anvende organiske synteser..
Et andet eksempel er bromering af n-hexan:
CH3CHtoCHtoCHtoCHtoCH3 + Brto => CH3(Br) CHCHtoCHtoCHtoCH3 + HBr
Igen anvendes i denne reaktion lys eller ultraviolet stråling til at fremme dannelsen af frie radikaler. Brom, da det er en dyprød væske, bliver misfarvet, når det reagerer og observerer således en farveændring fra rød til farveløs, når der dannes 2-bromhexan..
Tilsætning af hydrocider eller halogener til alkener
Den anden metode til opnåelse af alkylhalogenider består i behandling af alkoholer (ROH) eller alkener (RtoC = CRto) med hydrocider. Hydracider har den generelle formel HX (HF, HCI, HBr og HI). Et eksempel vises med ethanol for hver af dem:
CH3CHtoOH + HF => CH3CHtoF + HtoELLER
CH3CHtoOH + HCI => CH3CHtoCl + HtoELLER
CH3CHtoOH + HBr => CH3CHtoBr + HtoELLER
CH3CHtoOH + HI => CH3CHtoI + HtoELLER
Ligeledes kan alkener tilføje HX-molekyler til deres dobbeltbindinger og danne sekundære alkylhalogenider..
CHto= CH-CH3 + HBr => BrCHto-CHto-CH3 + CH3-CHBr-CH3
BrCH-produktetto-CHto-CH3 er 1-bromopropan, og CH3-CHBr-CH3 2-brompropan. Det andet er hovedproduktet, fordi det er det mest stabile, mens det første produceres i mindre grad, fordi det er mere ustabilt. Dette skyldes, at CH3CHBrCH3 er et sekundært alkylhalogenid.
Meget ens opstår, når det, der tilsættes alkenen, er et molekyle af Xto:
CHto= CH-CH3 + Brto => BrCHto-CHBr-CH3
Imidlertid opnås et alkylhalogenid med to bromatomer bundet til tilstødende carbonatomer; vicinalalkylhalogenid. Hvis du derimod havde de to brominer bundet til det samme kulstof, ville du have et geminalalkylhalogenid som følgende:
BrtoCH-CHto-CH3
Reaktioner
Nukleofil substitution
Reaktiviteterne af alkylhalogenider er baseret på sprødheden eller styrken af C-X-bindingen. Jo tungere halogen, jo svagere er bindingen, og derfor desto lettere brydes den. I en kemisk reaktion brydes bindinger, og der dannes nye; C-X-obligationer er brudt for at danne en C-G-binding (G = ny gruppe).
I mere passende termer fungerer X som en forlader gruppe og G som en indgående gruppe i en reaktion af nukleofil substitution. Hvorfor forekommer denne reaktion? Fordi X, som er mere elektronegativ end kulstof, "stjæler" elektrondensitet og efterlader det et underskud på elektroner, der oversættes som en positiv delvis ladning:
Cδ+-xδ-
Hvis en negativ art (: G-) eller neutral med et tilgængeligt elektronpar (: G), der er i stand til at danne en mere stabil C-G-binding, vil X ende med at blive erstattet af G. Ovenstående kan repræsenteres ved følgende kemiske ligning:
RX +: G- => RG + X-
Jo svagere C-X- eller R-X-bindingen er, jo større er dens reaktivitet eller tendens til at blive erstattet af nukleofilt middel (eller nukleofil) G; det vil sige elskere af kerner eller positive ladninger.
Eksempler
En række generelle ligninger for de nukleofile substitutioner, som alkylhalogenider kan gennemgå, er vist nedenfor:
RX + OH- => ROH + X- (Alkoholer)
+ ELLER''- => ROR'' (Ethers, Williamson syntese)
+ jeg- => RI (Alkyliodider)
+ CN- => RCN (nitriler)
+ R'COO- => RCOOR '(estere)
+ NH3 => RNHto (Aminer)
+ P (C6H5)3 => RP (C6H5)3+ x- (Phosphoniumsalte)
+ SH- => RSH (Thioler)
Fra disse eksempler kan det allerede mistænkes for, hvor værdifulde alkylhalogenider er for organiske synteser. En af de mange udskiftninger, der stadig blev citeret, er Friedel Crafts-reaktionen, der bruges til at "leje" aromatiske ringe:
RX + ArH + AlCl3 => ArR
I denne reaktion erstattes en H af den aromatiske ring med en R-gruppe fra RX.
Eliminering
Alkylhalogenider kan frigive HX-molekyler gennem en eliminationsreaktion; specifikt en dehydrohalogenering:
RtoCH-CXRto + Åh- => RtoC = CRto + HX
Det siges, at dehydrohalogenering opstår, fordi både et H og et X går tabt i det samme HX-molekyle.
Syntese af Grignard reagenser
Alkylhalogenider kan reagere med visse metaller til dannelse af Grignard-reagenset, der bruges til at tilføje R-grupper til andre molekyler. Den generelle ligning for dens syntese er som følger:
RX + Mg => RMgX
Eksempler
Forskellige eksempler på alkylhalogenider er allerede blevet nævnt gennem sektionerne. Nogle andre, enkle, er:
-Ethylchlorid, CH3CHtoCl
-Isopropylfluorid, (CH3)toCHtoF
-2-methyl-3-chlorpentan, CH3-CH (CH3) -CHCl-CHtoCH3
-sek-butyliodid, CH3CHtoCHtoI-CH3
-3-brom-6-iodheptan, CH3-CHto-CHBr-CHto-CHto-CHtojeg
-3,4-dibrom-1-penten, CH3-CHBr-CHBr-CH = CHto
Ansøgninger
Opløsningsmiddel
I tidligere afsnit blev nævnt opløsningsmiddelkapaciteten for alkylhalogeniderne. Industrien har udnyttet denne ejendom til at bruge dem som rengøringsmidler, hvad enten det er til tekstilmaterialer, elektroniske komponenter eller til at fjerne lakpletter..
På samme måde bruges de som opløsningsmidler til maling eller organiske eller fedtede prøver til utallige typer analytiske tests..
Organisk syntese
Alkylhalogenider er meget nyttige til "alkylering" af aromatiske ringe, mens de tjener som en startkilde til syntese af praktisk talt alle andre familier af organiske forbindelser. Syntetisk betragtes RX som en kilde til R-grupper eller kæder, som kan være ønsket til inkorporering i stærkt aromatiske forbindelser..
Farmaceutisk industri
Det blev nævnt i begyndelsen, at halogenatomer interagerer med biologiske matricer, så de i vores organismer ikke kan gå ubemærket hen uden at skabe en ændring, positiv eller negativ. Hvis et lægemiddel udøver en positiv effekt på kroppen med et halogenatom, kan denne virkning måske eller måske ikke øges.
Så hvis X er direkte bundet til et sp-hybridiseret carbon3, det vil have et alkylhalogenid og ikke et halogeneret derivat. Nogle af sådanne halogenider er vist nedenfor i følgende serie af billeder:
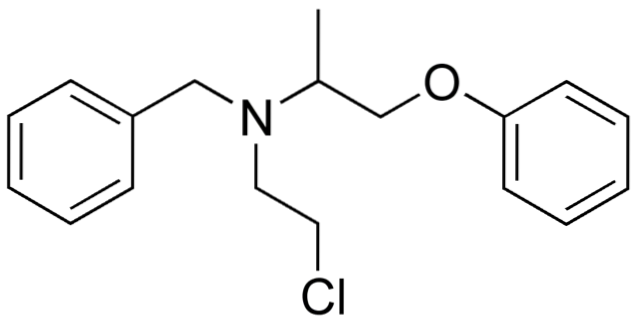
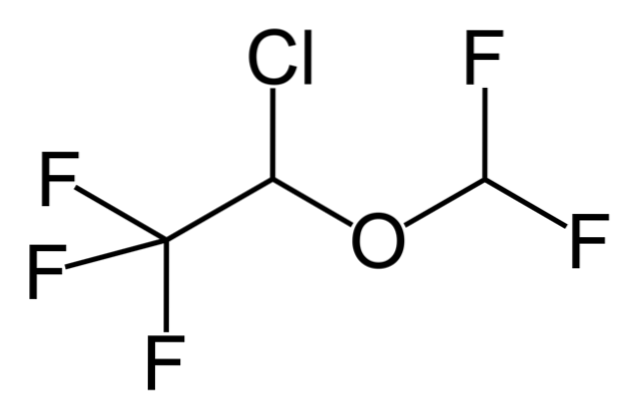


Bemærk, at der i disse fem lægemidler er mindst en CH-type bindingto-X eller CH-X; dvs. halogenet er bundet til et sp carbon3.
Kølemidler
Det berømte kølemiddel Freon-12 (CHCIFto), som andre fluoralkaner eller hydrofluorcarboner, erstattede ammoniakgasser og chlorfluorcarboner (CFC'er) i denne funktion, fordi selvom de er ikke-flygtige eller giftige stoffer, ødelægger de ozonlaget; mens freon-12, der er mere reaktiv, ødelægges, inden den når sådanne højder.
Referencer
- Carey F. (2008). Organisk kemi. (Sjette udgave). Mc Graw Hill.
- Clark Jim. (2016, 14. juli). Anvendelse af alkylhalogenider. Kemi LibreTexts. Gendannet fra: chem.libretexts.org
- Gál, B., Bucher, C., & Burns, N. Z. (2016). Chiral Alkyl Halides: Undersøgte motiver i medicin. Marine drugs, 14 (11), 206. doi: 10.3390 / md14110206
- Alkylhalogenider. Gendannet fra: chemed.chem.purdue.edu
- Patkar Prachi. (16. juli 2017). Alt om alkylhalogenider: egenskaber, anvendelser og meget mere. Videnskab slog. Gendannet fra: sciencestruck.com
- R. Skib. (2016). Alkylhalider. Gendannet fra: hyperphysics.phy-astr.gsu.edu
- Læringsvejledning til kapitel 9 - Alkylhalider I. Gendannet fra: cactus.dixie.edu
- Q.A. Eduardo Vega Barrios. (s.f.). Alkylhalogenider: Egenskaber, anvendelser og applikationer. [PDF. Gendannet fra: cvonline.uaeh.edu.mx



Endnu ingen kommentarer