
Heptan (C7H16) struktur, egenskaber og anvendelser
Det heptan er en organisk forbindelse, hvis kemiske formel er C7H16 og omfatter ni strukturelle isomerer, hvoraf den bedst kendte er lineær. Det er et carbonhydrid, specifikt en alkan eller paraffin, som findes i de fleste organiske kemilaboratorier, hvad enten det er undervisning eller forskning..
I modsætning til andre paraffiniske opløsningsmidler har heptan lavere flygtighed, hvilket gør det relativt sikrere at bruge; forudsat at der ikke er nogen varmekilde, der omgiver dine dampe, og du arbejder inde i en emhætte. Bortset fra dets antændelighed er det en forbindelse, der er inert nok til at tjene som medium til organiske reaktioner..
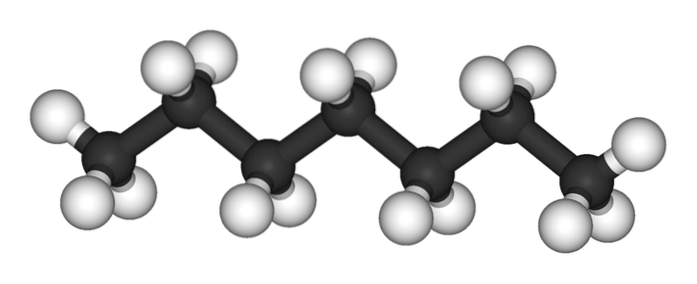
Det øverste billede viser strukturen på n-heptan, den lineære isomer af alle heptaner. Fordi det er den mest almindelige og kommercielt værdifulde isomer såvel som den nemmeste at syntetisere, har det tendens til at forstås, at udtrykket 'heptan' kun refererer til n-heptan; medmindre andet er angivet.
Imidlertid specificerer flaskerne af denne flydende forbindelse, at den indeholder n-heptan. De skal afdækkes inde i en emhætte, og målinger tages omhyggeligt.
Det er et fremragende opløsningsmiddel til fedt og olier, hvorfor det ofte bruges under ekstraktioner af planteessenser eller andre naturlige produkter..
Artikelindeks
- 1 Struktur
- 1.1 n-heptan og dets intermolekylære interaktioner
- 1.2 Isomerer
- 2 Egenskaber for heptan
- 2.1 Fysisk udseende
- 2.2 Molær masse
- 2.3 Smeltepunkt
- 2.4 Kogepunkt
- 2.5 Damptryk
- 2.6 Tæthed
- 2.7 Opløselighed i vand
- 2.8 Opløselighed i andre opløsningsmidler
- 2.9 Brydningsindeks (nD)
- 2.10 Viskositet
- 2.11 Varmekapacitet
- 2.12 Flammepunkt
- 2.13 Selvantændelsestemperatur
- 2.14 Overfladespænding
- 2.15 Forbrændingsvarme
- 2.16 Reaktivitet
- 3 anvendelser
- 3.1 Opløsningsmiddel og reaktionsmedium
- 3.2 Nedbørsmiddel
- 3.3 Octan
- 4 Referencer
Struktur
n-heptan og dets intermolekylære interaktioner
Som det kan ses på det første billede, er molekylet af n-Heptan er lineær, og på grund af den kemiske hybridisering af dets carbonatomer antager kæden en zigzagform. Dette molekyle er dynamisk, da dets CC-bindinger kan rotere, hvilket får kæden til at bøje sig let i forskellige vinkler. Dette bidrager til deres intermolekylære interaktioner..
Det n-heptan er et apolært, hydrofobt molekyle, og derfor er dets interaktioner baseret på de London-spredningskræfter; Disse er dem, der afhænger af forbindelsens molekylvægt og dens kontaktareal. To molekyler af n-heptan nærmer sig hinanden på en sådan måde, at de "kiler" deres kæder oven på hinanden.
Disse interaktioner er effektive nok til at holde molekylerne af n-Heptan er sammenhængende i en væske, der koger ved 98 ºC.
Isomerer
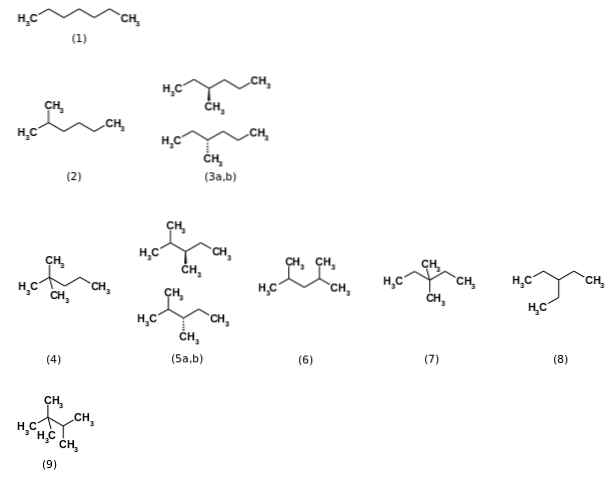
Først blev det sagt, at formlen C7H16 repræsenterede i alt ni strukturelle isomerer, idet de n-heptan den mest relevante (1). De øvrige otte isomerer er vist på billedet ovenfor. Bemærk med det samme, at nogle er mere forgrenede end andre. Fra venstre mod højre, startende fra toppen, har vi:
(2): 2-methylhexan
(3): 3-methylhexan, som består af et par enantiomerer (a og b)
(4): 2,2-dimethylpentan, også kendt som neoheptan
(5): 2,3-dimethylpentan, igen med et par enantiomerer
(6): 2,4-dimethylpentan
(7): 3,3-dimethylpentan
(8): 3-ethylpentan
(9): 2,2,3-trimethylbutan.
Hver af disse isomerer har egenskaber og applikationer uafhængig af n-heptan, hovedsagelig forbeholdt organiske syntesområder.
Heptan egenskaber
Fysisk fremtoning
Farveløs væske med en benzinlignende lugt.
Molar masse
100,205 g / mol
Smeltepunkt
-90.549 ºC, bliver en molekylær krystal.
Kogepunkt
98,38 ºC.
Damptryk
52,60 atm ved 20 ° C. Bemærk, hvor højt dets damptryk er, på trods af at det er mindre flygtigt end andre paraffiniske opløsningsmidler, såsom hexan og pentan..
Massefylde
0,6795 g / cm3. På den anden side er heptandampe 3,45 gange tættere end luft, hvilket betyder, at dens damp vil blive hængende i rum, hvor lidt af dens væske spildes..
Vandopløselighed
Heptan, der er en hydrofob forbindelse, kan næppe opløses i vand til dannelse af en opløsning med en koncentration på 0,0003% ved en temperatur på 20 ºC..
Opløselighed i andre opløsningsmidler
Heptan kan blandes med carbontetrachlorid, ethanol, acetone, let petroleum og chloroform..
Brydningsindeks (nD)
1.3855.
Viskositet
0,389 mPa s
Varmekapacitet
224,64 J / K mol
antændelsespunkt
-4 ºC
Selvantændelsestemperatur
223 ºC
Overfladespænding
19,66 mN / m ved 25 ºC
Forbrændingsvarme
4817 kJ / mol.
Reaktivitet
Heptandampe, når de er tæt på en varmekilde (en flamme), reagerer eksotermt og kraftigt med iltet i luften:
C7H16 + 11Oto => 7COto + 8HtoELLER
Uden for forbrændingsreaktionen er heptan imidlertid en forholdsvis stabil væske. Dens manglende reaktivitet skyldes, at dets CH-bindinger er vanskelige at bryde, så det er ikke modtageligt for substitutioner. Ligeledes er det ikke særlig følsomt over for stærke oxidationsmidler, så længe der ikke er ild i nærheden..
Den største fare for heptan er dens høje flygtighed og antændelighed, så der er risiko for brand, hvis det spildes på varme steder.
Ansøgninger
Opløsningsmiddel og reaktionsmedium

Den hydrofobe karakter af heptan gør det til et fremragende opløsningsmiddel til opløsning af olier og fedtstoffer. I dette aspekt er det blevet brugt som affedtningsmiddel. Imidlertid ligger dets største anvendelse i at blive brugt som et ekstraherende opløsningsmiddel, da det opløser lipidkomponenterne såvel som de andre organiske forbindelser i en prøve..
For eksempel, hvis du ønskede at udvinde alle komponenterne i malet kaffe, ville det blive masereret i heptan i stedet for vand. Denne metode og dens variationer er implementeret med alle frøtyper, takket være hvilke planteessenser og andre naturlige produkter er opnået..
Heptan, som er naturligt farveløs, vil farve til den ekstraherede olie. Derefter roteres det for endelig at have et volumen af den olie, der er så ren som muligt..
På den anden side tillader den lave reaktivitet af heptan det også at være en mulighed, når man overvejer et reaktionsmedium til at udføre en syntese. At være et godt opløsningsmiddel til organiske forbindelser, sikrer det, at reagenserne forbliver i opløsning og interagerer korrekt med hinanden, mens de reagerer.
Nedbørsmiddel
I petroleumskemi er det almindelig praksis at udfælde asfaltener fra en rå prøve ved tilsætning af heptan. Denne metode gør det muligt at undersøge stabiliteten af forskellige råolier og bestemme, hvor modtageligt deres asfaltenindhold er for udfældning og forårsager en hel række problemer for olieindustrien..
Octane
Heptan er blevet brugt som brændstof på grund af den store mængde varme, det afgiver, når det brænder. For bilmotorer ville det dog være skadeligt for deres ydeevne, hvis de blev brugt i ren form. Fordi det brænder meget eksplosivt, tjener det til at definere 0 på benzinoktanskalaen..
Benzin indeholder en høj procentdel af heptan og andre kulbrinter for at bringe oktantallet op til kendte værdier (91, 95, 87, 89 osv.).
Referencer
- Morrison, R. T. og Boyd, R, N. (1987). Organisk kemi. 5. udgave. Redaktionel Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kemi. (Sjette udgave). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. (10. udgave.). Wiley plus.
- Wikipedia. (2020). Heptan. Gendannet fra: en.wikipedia.org
- National Center for Biotechnology Information. (2020). Heptan PubChem-database. CID = 8900. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Elsevier B.V. (2020). Heptaner ScienceDirect. Gendannet fra: sciencedirect.com
- Bell Chem Corp. (7. september 2018). Industriel anvendelse af heptan. Gendannet fra: bellchem.com
- Andrea Kropp. (2020). Heptan: struktur, anvendelser og formel. Undersøgelse. Gendannet fra: study.com



Endnu ingen kommentarer