
Kemisk hybridisering sp, sp2, sp3
Det kemisk hybridisering det er "blandingen" af atomorbitaler, hvis koncept blev introduceret af kemiker Linus Pauling i 1931 for at dække manglerne i Valencia Bond Theory (TEV). Hvilke ufuldkommenheder? Disse er: molekylære geometrier og ækvivalente bindingslængder i molekyler såsom methan (CH4).
Ifølge TEV danner C-atomorbitalerne i metan fire σ-bindinger med fire H-atomer. 2p-orbitalerne med formformer (nederste billede) af C er vinkelrette på hinanden, så H skal være ca. et par fra andre på en 90º vinkel.
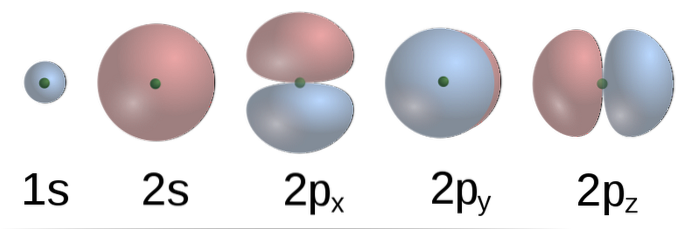
Derudover binder 2s (sfærisk) orbital af C til 1s orbital af H i en vinkel på 135 ° i forhold til de andre tre H. Imidlertid har det eksperimentelt vist sig, at vinklerne i CH4 er 109,5º, og at derudover er længderne af C-H-obligationer ækvivalente.
For at forklare dette skal en kombination af de originale atomorbitaler betragtes som fire degenererede hybridorbitaler (af samme energi). Her kommer kemisk hybridisering i spil. Hvordan er hybridorbitaler? Det afhænger af de atomorbitaler, der genererer dem. De udviser også en blanding af de elektroniske egenskaber ved disse.
Artikelindeks
- 1 sp3 hybridisering
- 1.1 Fortolkning
- 1.2 Afvigelser af bindingsvinkler
- 2 sp2 hybridisering
- 3 sp hybridisering
- 4 Referencer
Sp hybridisering3
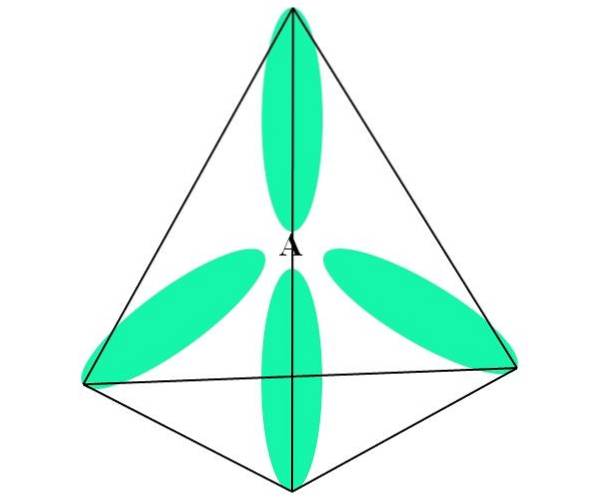
I tilfælde af CH4, hybridisering af C er sp3. Fra denne tilgang forklares molekylær geometri med fire sp orbitaler3 109,5º fra hinanden og peger mod en tetraederes hjørner.
På det øverste billede kan du se, hvordan sp orbitaler3 (farvet grøn) etablere et tetraedrisk elektronisk miljø omkring atomet (A, som er C for CH4).
Hvorfor 109,5 ° og ikke andre vinkler for at "tegne" en anden geometri? Årsagen er, at denne vinkel minimerer de elektroniske frastød fra de fire atomer, der binder til A.
CH-molekylet4 kan repræsenteres som en tetraeder (tetrahedral molekylær geometri).
Hvis i stedet for H dannede C bindinger med andre grupper af atomer, hvad ville så deres hybridisering være? Så længe kulstof danner fire σ (C-A) bindinger, vil deres hybridisering være sp3.
Det kan følgelig antages, at i andre organiske forbindelser såsom CH3OH, CCl4, C (CH3)4, C6H12 (cyclohexan) osv., har carbon sp-hybridisering3.
Dette er vigtigt for at skitsere organiske strukturer, hvor enkeltbundne carbonatomer repræsenterer punkter for divergens; strukturen forbliver ikke i et enkelt plan.
Fortolkning
Hvad er den enkleste fortolkning af disse hybridorbitaler uden at tage fat på de matematiske aspekter (bølgefunktionerne)? Sp orbitalerne3 antyde, at de stammer fra fire orbitaler: en s og tre s.
Fordi kombinationen af disse atomorbitaler antages at være ideel, er de fire sp orbitaler3 resulterende er identiske og indtager forskellige retninger i rummet (såsom i p-orbitalernex, sY Og sz).
Ovenstående gælder for resten af de mulige hybridiseringer: antallet af dannede hybridorbitaler er det samme som for de atomare orbitaler, der kombineres. For eksempel sp hybrid orbitaler3dto er dannet af seks atomorbitaler: en s, tre p og to d.
Bindingsvinkelafvigelser
Ifølge Valencia Shell Electronic Pair Repulsion Theory (RPECV) optager et par frie elektroner mere volumen end et bundet atom. Dette får leddene til at bevæge sig fra hinanden, reducerer den elektroniske spænding og afviger vinklerne fra 109,5º:
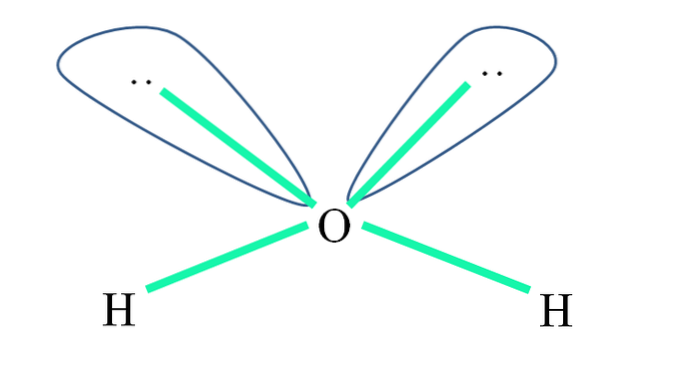
For eksempel er H-atomer i vandmolekylet bundet til sp-orbitalerne3 (i grønt) og ligeledes de ikke-delte elektronpar ":" besætter disse orbitaler.
Frastødningen af disse elektronpar er normalt repræsenteret som "to kloder med øjne", som på grund af deres volumen afviser de to σ O-H-bindinger.
Således er bindingsvinklerne i vand faktisk 105 ° i stedet for de 109,5 °, der forventes for tetrahedral geometri..
Hvilken geometri gør H såtoELLER? Den har en vinkelgeometri. Hvorfor? For selvom den elektroniske geometri er tetraedrisk, fordrejer to par ikke-delte elektroner den til en vinkelmolekylær geometri.
Sp hybridiseringto
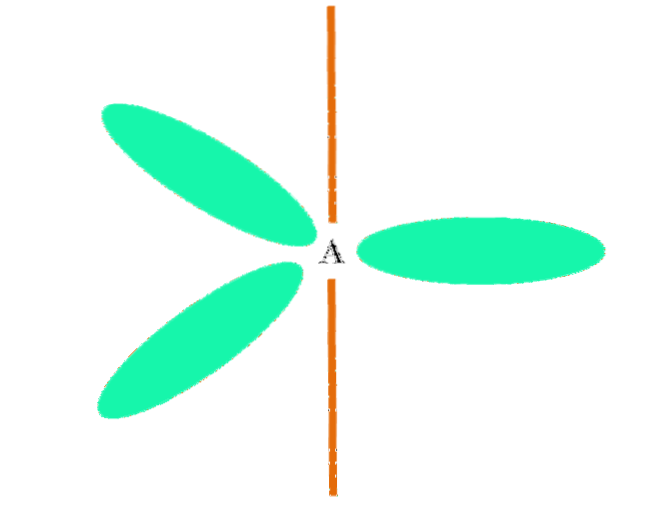
Når et atom kombinerer to p og en s orbitaler, genererer det tre hybrid sp orbitalerto; en p-orbital forbliver dog uændret (fordi der er tre af dem), som er repræsenteret som en orange bjælke i det øverste billede.
Her er de tre sp orbitalerto de er farvede grønne for at fremhæve deres forskel fra den orange bjælke: den "rene" p-orbital.
Et atom med sp hybridiseringto kan visualiseres som et fladt trigonal gulv (trekanten tegnet med sp-orbitalerneto grøn), med sine hjørner adskilt af 120º vinkler og vinkelret på en søjle.
Og hvilken rolle spiller den rene orbital? Det at danne en dobbeltbinding (=). SP-orbitalerneto tillade dannelse af tre σ-bindinger, mens den rene p-orbitale π-binding (en dobbelt- eller tredobbeltbinding indebærer en eller to π-bindinger).
For eksempel at tegne carbonylgruppen og strukturen af formaldehydmolekylet (HtoC = O), fortsætter den som følger:
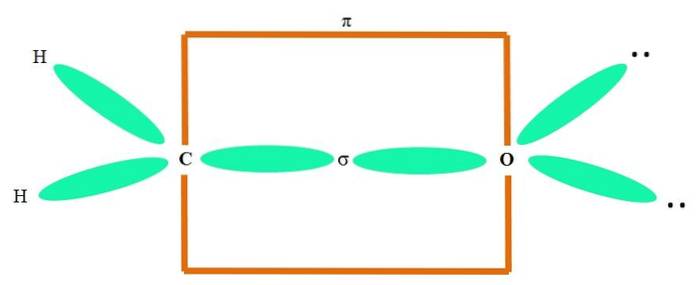
Sp orbitalerneto både C og O danner en σ-binding, mens deres rene orbitaler danner en π-binding (det orange rektangel).
Det kan ses, hvordan resten af de elektroniske grupper (H-atomer og de ikke-delte elektronpar) er placeret i de andre sp-orbitaler.to, adskilt af 120º.
Sp hybridisering
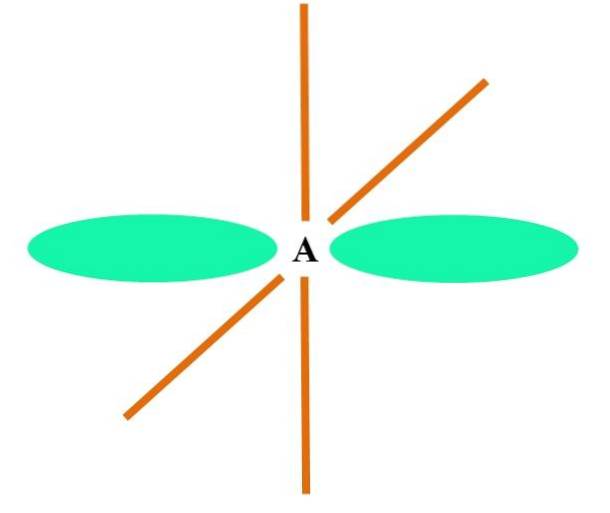
På det øverste billede er et A-atom med sp-hybridisering illustreret. Her kombineres en s-orbital og en p-orbital for at give anledning til to degenererede sp-orbitaler. Imidlertid forbliver nu to rene p-orbitaler uændrede, hvilket gør det muligt for A at danne to dobbeltbindinger eller en tredobbeltbinding (≡).
Med andre ord: hvis en C overholder ovenstående i en struktur (= C = eller C2C), er dens hybridisering sp. For andre mindre illustrative atomer - som overgangsmetaller - er beskrivelsen af elektroniske og molekylære geometrier kompliceret, fordi d-orbitaler og endda f-orbitaler også overvejes..
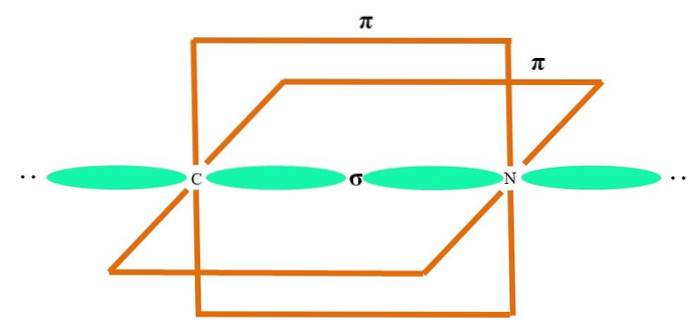
Hybridorbitalerne er 180 ° fra hinanden. Af denne grund er de bundne atomer arrangeret i en lineær molekylgeometri (BB-B). Endelig viser det nederste billede strukturen af cyanidanionen:
Referencer
- Sven. (3. juni 2006). S-p-orbitaler. [Figur]. Hentet den 24. maj 2018 fra: commons.wikimedia.org
- Richard C. Banks. (Maj 2002). Limning og hybridisering. Hentet den 24. maj 2018 fra: chemistry.boisestate.edu
- James. (2018). En genvej til hybridisering. Hentet den 24. maj 2018 fra: masterorganicchemistry.com
- Dr. Ian Hunt. Institut for Kemi, University of Calgary. sp3 hybridisering. Hentet den 24. maj 2018 fra: chem.ucalgary.ca
- Chemical Bonding II: Molecular Geometry and Hybridization of Atomic Orbitals Chapter 10. [PDF]. Hentet den 24. maj 2018 fra: wou.edu
- Quimitube. (2015). Kovalent binding: En introduktion til atomisk orbital hybridisering. Hentet den 24. maj 2018 fra: quimitube.com
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave., S. 51). Mc Graw Hill.


Endnu ingen kommentarer