
Hvad er hydrolyse og eksempler på reaktioner

Det hydrolyse Det er en kemisk reaktion, der kan forekomme i både uorganiske og organiske molekyler eller ioner, og det involverer deltagelse af vand for at bryde deres bindinger. Dets navn stammer fra græsk, 'hydro' af vand og 'lysis' af brud.
Vandmolekylet, HtoEller det etablerer en ligevægt med ionerne af salte af svage syrer og baser, hvilket koncept optræder for første gang i generelle kemistudier og i analytisk kemi. Det er derfor en af de enkleste kemiske reaktioner.
I flere eksempler på hydrolyse er vand alene ude af stand til at bryde en bestemt kovalent binding. Når dette sker, accelereres eller katalyseres processen ved forsuring eller alkalisering af mediet; det vil sige i nærværelse af H-ioner3ELLER+ u OH-, henholdsvis. Ligeledes er der enzymer, der katalyserer hydrolyse.
Hydrolyse indtager et særligt sted, når det kommer til biomolekyler, da bindingerne, der holder deres monomerer sammen, er modtagelige for hydrolysering under visse betingelser. For eksempel hydrolyseres sukker for at nedbryde polysaccharider i deres bestanddele monosaccharider takket være virkningen af glucosidasenzymer.
Artikelindeks
- 1 Hvad er hydrolyse?
- 2 Eksempler på hydrolysereaktioner
- 2.1 - ATP
- 2.2 - Vand
- 2.3 - Proteiner
- 2.4 - Amider og estere
- 2,5 - Syre-base
- 3 Referencer
Hvad er hydrolyse?
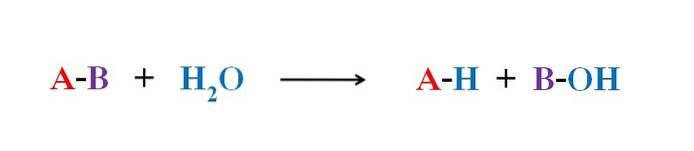
Billedet ovenfor forklarer, hvad hydrolyse består af. Bemærk, at ikke kun molekylet eller substratet (hvis enzymer medierer) bryder dets binding, men også selve vandet, som "bryder" ind i H+ og OH-, hvor H+ ender med A og OH- med B. A-B reagerer således med et vandmolekyle, der producerer to produkter, A-H og B-OH.
Hydrolyse er derfor den modsatte reaktion på kondens. I kondensationen forbinder to produkter, for at sige A-H og B-OH, ved hjælp af frigørelsen af et lille molekyle: vandet. I hydrolyse forbruges et molekyle, mens det i kondens frigives eller produceres.
Vend tilbage til eksemplet med sukker, antag at A-B svarer til en saccharose-dimer, hvor A repræsenterer glucose, og B repræsenterer fruktose. Bindingen A-B, glykosidisk, kan hydrolyseres for at stamme fra de to monosaccharider hver for sig og i opløsning, og det samme sker med oligo og polysaccharider, hvis enzymer medierer i sådanne reaktioner.
Bemærk, at i denne reaktion, A-B, har pilen kun en retning; det vil sige, det er en irreversibel hydrolyse. Imidlertid er mange hydrolyse faktisk reversible reaktioner, der når en ligevægt.
Eksempler på hydrolysereaktioner
- ATP
ATP er stabil mellem pH-værdier på 6,8 og 7,4. Imidlertid hydrolyserer den ved ekstreme pH-værdier spontant. Hos levende væsener katalyseres hydrolyse af enzymer kendt som ATPaser:
ATP + HtoO => ADP + Pi
Denne reaktion er stærkt exergon, da ADP's entropi er større end ATP. Variationen af Gibbs fri energi (ΔGº) er - 30,5 kJ / mol. Den energi, der produceres ved hydrolyse af ATP, anvendes i adskillige endergoniske reaktioner.
Parede reaktioner
I nogle tilfælde anvendes hydrolysen af ATP til omdannelse af en forbindelse (A) til en forbindelse (B).
A + ATP + HtoELLER <=> B + ADP + Pi + H+
- Vand
To vandmolekyler kan reagere med hinanden i tilsyneladende hydrolyse:
HtoO + HtoELLER <=> H3ELLER+ + Åh-
Det er som om et af disse vandmolekyler brækkede ind i H+ og OH-, vil forbinde H+ til oxygenatom i det andet vandmolekyle, hvilket giver hydroniumionen, H3ELLER+. Denne reaktion handler mere end hydrolyse om autoionisering eller autoprotolyse af vand.
- Protein
Proteiner er stabile makromolekyler, og for at opnå deres fuldstændige hydrolyse kræves ekstreme forhold i de aminosyrer, der udgør dem; såsom en koncentration af saltsyre (6 M) og høje temperaturer.
Imidlertid er levende væsener udstyret med et enzymatisk arsenal, der tillader hydrolyse af proteiner i aminosyrer i tolvfingertarmen. Enzymerne, der er involveret i proteinfordøjelse, udskilles næsten udelukkende af bugspytkirtlen.
Der er exopeptidaseenzymer, der nedbryder proteiner, der starter ved deres ender: aminopeptidase i aminoenden og carboxypeptidase i carboxylenden. Endopeptidaseenzymer udøver deres virkning inde i proteinkæden, for eksempel: trypsin, pepsin, chymotrypsin osv..
- Amider og estere
Amider giver, når de opvarmes i et alkalisk medium, en carboxylsyre og en amin:
RCONHto + HtoO => RCOO- + NHto
Estere i et vandigt medium hydrolyseres til en carboxylsyre og en alkohol. Fremgangsmåden katalyseres af enten en base eller en syre:
RCO-OR '+ HtoO => RCOOH + R'OH
Dette er den berømte forsæbningsreaktion.
- Syre-base
I vand hydrolyseres adskillige arter til forsuring eller alkalisering af det vandige medium.
Tilsætning af et grundlæggende salt
Natriumacetat, et basisk salt, dissocieres i vand for at give Na-ioner+ (natrium) og CH3COO- (acetat). Dens basalitet skyldes det faktum, at acetat hydrolyseres til dannelse af OH-ioner-, mens natrium forbliver uændret:
CH3COO- + HtoELLER <=> CH3COOH + OH-
OH- er ansvarlig for, at pH stiger og bliver basisk.
Tilsætning af et syresalt
Ammoniumchlorid (NH4Cl) dannes af chloridionen (Cl-) fra saltsyre (HCI), en stærk syre og ammoniumkationen (NH4+fra ammoniumhydroxid (NH4OH), en svag base. Cl- Det adskiller sig ikke i vand, men ammoniumkationen omdannes til vand som følger:
NH4+ + HtoELLER <=> NH3 + H3ELLER+
Hydrolysen af ammoniumkationen frembringer protoner, der øger surheden i et vandigt medium, så det konkluderes, at NH4Cl er et surt salt.
Tilsætning af et neutralt salt
Natriumchlorid (NaCl) er et saltprodukt fra omsætningen af en stærk base (NaOH) med en stærk syre (HCI). Ved opløsning af natriumchlorid i vand natriumkationen (Na+) og anionen (Cl-). Begge ioner adskiller sig ikke i vand, så de tilføjer ikke H+ u OH-, holder sin pH konstant.
Derfor siges natriumchlorid at være et neutralt salt..
Referencer
- Mathews, C. K., van Holde, K. E. og Ahern, K. G. (2002). Biokemi. (Tredje udgave). Redigere. Pearson-Addison Wesley.
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Helmenstine, Anne Marie, Ph.D. (13. januar 2019). Hydrolyse: Definition og eksempler. Gendannet fra: thoughtco.com
- Theresa Phillips. (28. april 2019). En forklaring på hydrolyseprocessen. Gendannet fra: thebalance.com
- Redaktørerne af Encyclopaedia Britannica. (2016, 16. november). Hydrolyse. Encyclopædia Britannica. Gendannet fra: britannica.com
- Wikipedia. (2019). Hydrolyse. Gendannet fra: en.wikipedia.org



Endnu ingen kommentarer