
Immunfluorescens begrundelse, protokol og applikationer
Det immunfluorescens er en kraftfuld immunfarvningsteknik, der bruger antistoffer kovalent bundet til fluorescerende molekyler til at identificere specifikke mål i celleprøver, der er fikseret på en fast understøtning.
Denne teknik involverer mikroskopisk observation med immunologisk specificitet, hvilket gør det muligt at observere levende eller døde celler, der kan præsentere små mængder antigener. Det bruges i vid udstrækning både inden for forskning og klinisk diagnose af forskellige patologier.
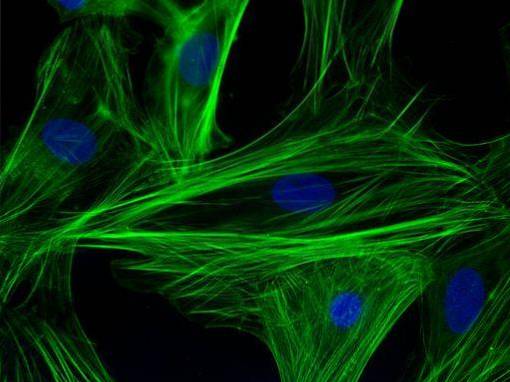
Denne teknik, hovedsagelig kvalitativ (med nogle kvantitative varianter), har specifikt at gøre med visualisering af en prøve ved produktsignalet fra en fluorofor, som er et fluorescerende molekyle bundet til et antistof, og som er i stand til at blive exciteret ved en bestemt bølgelængde ..
I cellulær sammenhæng er det meget nyttigt at undersøge tilstedeværelsen / fraværet og subcellulære placering af proteiner. Teknikken blev brugt i sine tidlige dage i den kliniske indstilling til diagnose af vira som influenza og efterfølgende til mange andre infektiøse sygdomme..
Det er en meget følsom teknik, og med det passende mikroskopiudstyr kan den have en meget god opløsning. Det kræver, for at det kan observeres, anvendelse af konfokal- eller epifluorescensmikroskoper.
På trods af at det er meget populært, kan det imidlertid byde på nogle vigtige problemer med hensyn til at opnå uspecifik fluorescens, der genererer noget baggrundsstøj, hvilket ofte begrænser den tilstrækkelige aflæsning af resultaterne..
Artikelindeks
- 1 begrundelse
- 2 Protokol
- 2.1-Forberedelse
- 2.2 Fiksering af prøver
- 2.3 Permeabilisering
- 2.4 Blokering
- 2.5 Immunfarvning eller immunfarvning
- 2.6 Montering og observation
- 3 typer
- 3.1 Direkte eller primær immunfluorescens
- 3.2 Indirekte eller sekundær immunfluorescens
- 4 applikationer
- 5 Referencer
Basis
Immunfluorescens er baseret på udnyttelsen af det biologiske fænomen i interaktionsreaktionen mellem et antistof og et antigen. Det har specifikt at gøre med visualisering eller påvisning af denne reaktion ved hjælp af spændende fluorescerende molekyler ved en bestemt bølgelængde.
Et antistof er et immunglobulinprotein udskilt fra aktive B-celler, som specifikt genereres mod et antigen, hvortil det kan binde med stor affinitet og specificitet. Immunfluorescens gør brug af IgG-immunglobuliner, som er opløselige i blodserum..
Antistoffer er molekyler op til 950 kDa sammensat af to korte (lette) og to lange "Y" -formede (tunge) peptidkæder. Både lette og tunge kæder er opdelt i to domæner: en variabel, der er i stand til at genkende antigenet, og en anden konstant eller konserveret, karakteristisk for hver art..
Antigener defineres funktionelt som molekyler, der kan genkendes af et antistof og for det meste er proteiner. Når et dyr udsættes for et antigen, aktiveres immunsystemets lymfocytter, der producerer specifikke antistoffer mod det, og som fungerer som et forsvarssystem.
Et antigen, såsom et protein, kan for eksempel have mere end en epitop eller et sted for genkendelse af et antistof, så serumet fra dyret, der udsættes for et antigen, kan have polyklonale antistoffer mod forskellige regioner af det samme protein..
Immunfluorescens udnytter derefter et dyrs evne til at producere polyklonale antistoffer mod et specifikt antigen for at rense det og derefter bruge det til påvisning af det samme antigen i andre sammenhænge..
Blandt de fluorescerende farvestoffer eller molekyler, der er mest brugt til nogle immunfluorescensteknikker, er fluoresceinisothiocyanat (FITC), tetramethylrhodaminisothiocyanat-5 og 6 (TRITC), mange cyaniner såsom Cy2, Cy3, Cy5 og Cy7 og farvestoffer kaldet Alexa Fluor®, såsom Alexa Fluor®448.
Protokol
Immunfluorescensprotokollen varierer afhængigt af mange faktorer, men generelt omfatter den en lineær sekvens af trin bestående af:
- Klargøring af objektglas og celler
- Fiksering af prøver
- Permeabilisering
- Blokering
- Immunfarvning eller immunfarvning
- Samling og observation
-Forberedelse
Af prøverne
Forberedelsen af prøverne afhænger af deres art og typen af erfaring, der skal udføres. Dernæst vil den enkleste sag blive forklaret, som involverer brugen af celler i suspension..
Celler i suspension, dvs. i et flydende dyrkningsmedium, skal først adskilles fra det ved centrifugering og derefter vaskes med en bufferopløsning eller "buffer " isosmotisk og bevarer dets integritet.
Normalt anvendes en phosphatsaltopuffer kendt som PBS, hvor cellerne resuspenderes, og denne blanding centrifugeres igen for at opnå cellerne fri for dyrkningsmediet, som kan indeholde interfererende stoffer..
Af knivene
De dias, der anvendes til mikroskopisk observation, hvor cellerne senere vil blive fikseret til de tilsvarende nedstrømsbehandlinger, skal også forberedes omhyggeligt..
Disse dækkes eller "sensibiliseres" med en opløsning af poly-lysin, en syntetisk polymer, der fungerer som en "molekylær lim" mellem cellerne og den faste understøtning takket være den elektrostatiske interaktion mellem de positive ladninger af deres aminogrupper og celler. negative ladninger på proteinerne, der overtrækker celler.
Fiksering af prøver
Denne proces består i at immobilisere proteinerne, der findes i cellen for at holde deres rumlige placering intakt. De anvendte molekyler skal være i stand til at krydse alle typer cellemembraner og danne gitter med kovalente proteiner..
Formaldehyd og paraformaldehyd, glutaraldehyd og endda methanol anvendes i vid udstrækning, hvormed celleprøver inkuberes i et bestemt tidsrum og derefter vaskes med en isosmotisk bufferopløsning.
Efter fiksering af cellerne vedhæftes de fortsat de ark, der tidligere er sensibiliseret med poly-lysin..
Permeabilisering
Afhængigt af den type test, der udføres, vil det være nødvendigt at permeabilisere cellerne, der undersøges, eller ej. Hvis det, der søges, er at kende placeringen, tilstedeværelsen eller fraværet af et bestemt protein på celleoverfladen, er permeabilisering ikke nødvendig.
På den anden side, hvis du vil vide placeringen af et protein inde i cellen, er permeabilisering vigtig og vil bestå af inkubering af prøverne med Triton X-100, et vaskemiddel, der er i stand til at permeabilisere cellemembraner..
Blokering
Et grundlæggende trin i alle immunologiske teknikker er blokering. På dette trin af proceduren består blokering af at dække alle stederne med poly-lysinmolekyler, som celler ikke klæber til, i de sensibiliserede ark. Det vil sige, det forhindrer enhver uspecifik union.
Normalt anvendes blokerende opløsninger med bovint serumalbumin (BSA) i PBS-buffer, og de bedste resultater opnås jo længere inkubationstiden med denne opløsning. Efter hvert trin, inklusive blokering, er det nødvendigt at vaske den resterende opløsning af..
Immunfarvning eller immunfarvning
Immunfarvningsproceduren eller immunfarvningsproceduren afhænger hovedsageligt af, om det er en direkte eller indirekte immunfluorescens (se nedenfor)..
Hvis det er en primær eller direkte immunfluorescens, inkuberes prøverne med de ønskede antistoffer, som skal kobles til de fluorescerende farvestoffer. Inkubationsproceduren består i at fremstille en fortynding af antistoffet i en opløsning, der også indeholder BSA, men i en lavere andel.
Når sagen er sekundær eller indirekte immunfluorescens, skal der udføres to på hinanden følgende inkubationer. Først med de ønskede antistoffer og derefter med de antistoffer, der er i stand til at detektere de konstante regioner i de primære immunglobuliner. Det er disse sekundære antistoffer, der er bundet kovalent til fluoroforer..
Teknikken er meget alsidig og tillader samtidig mærkning af mere end et antigen pr. Prøve, så længe der er primære antistoffer koblet til forskellige fluoroforer, i tilfælde af direkte immunfluorescens..
Til samtidig mærkning i indirekte immunfluorescens er det nødvendigt at sikre, at hvert primære antistof produceres i et andet dyr, såvel som at hvert sekundært antistof er koblet til en anden fluorofor..
Ligesom blokering giver inkubation med antistoffer bedre resultater jo længere inkubationstiden er. Efter hvert trin er det nødvendigt at vaske de overskydende antistoffer, der ikke binder til prøverne, og i den sekundære immunfluorescens er det nødvendigt at blokere, før det sekundære antistof tilsættes.
Visse teknikker bruger andre pletter, der ikke er relateret til immunfarvning, såsom farvning af nukleart DNA med DAPI-fluoroforen..
Samling og observation
I løbet af den sidste inkubationstid med fluoroforerne er det nødvendigt, at prøverne forbliver i mørke. Til mikroskopisk observation er det almindeligt at bruge nogle stoffer til at bevare fluorescensen af fluorophorerne koblet til antistofferne..
Typer
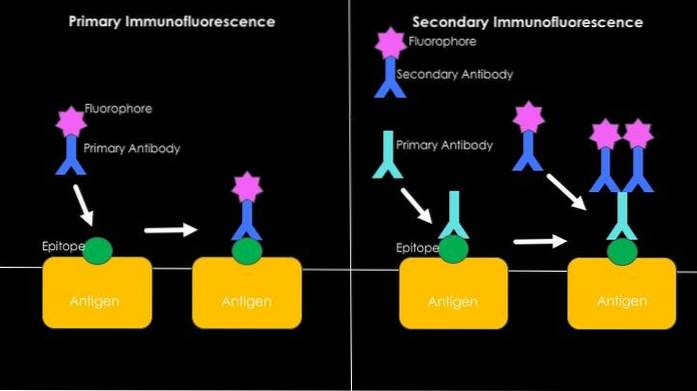
Direkte eller primær immunfluorescens
Det har at gøre med påvisning af antigener ved anvendelse af fluorescerende antistoffer. Den største fordel ved at bruge denne teknik er dens hastighed, men mange tilfælde af uspecifik binding kan forekomme i processen, især når man studerer humant sera, da de er rige på meget heterogene antistoffer..
Indirekte eller sekundær immunfluorescens
Det er også kendt som "sandwich" -teknikken, og dette involverer udviklingen af teknikken i to trin. Den første har at gøre med anvendelsen af et ikke-fluorescerende antistof og dets binding til antigenet af interesse..
Mod den konstante region af dette første antistof (som nu vil tjene som antigen) anvendes et andet antistof, der er i stand til at genkende det, der er forbundet med et fluorescerende molekyle.
Udseendet af et fluorescerende signal vil være resultatet af specifik genkendelse mellem det første ikke-fluorescerende antistof og antigenet af interesse; tilstedeværelsen af dette første antistof bestemmer det for det andet, der er mærket, og takket være hvilket tilstedeværelsen eller fraværet af antigenet kan bestemmes.
På trods af at det er en meget mere tidskrævende teknik end direkte immunfluorescens (da den inkluderer endnu et inkubationstrin), involverer denne teknik ikke designet af et fluorescerende antistof for hvert antigen, der undersøges, hvilket resulterer i økonomiske termer mere levedygtigt.
Desuden er det en mere følsom teknik med hensyn til signalamplifikation, da mere end et sekundært antistof kan binde til det konstante område af det primære antistof og således forstærke intensiteten af det fluorescerende signal..
Ansøgninger
Som tidligere nævnt er immunfluorescens en ekstremt alsidig teknik, der har fået en række anvendelser inden for det videnskabelige og kliniske område. Det kan bruges til at besvare økologiske, genetiske og fysiologiske spørgsmål vedrørende mange organismer.
Blandt de kliniske anvendelser anvendes det til direkte diagnose af nogle dermatologiske sygdomme, enten ved anvendelse af direkte eller indirekte immunfluorescens på epitelvæv hos de undersøgte patienter..
Immunfluorescensteknikker har været tilgængelige i encellede organismer, såsom gær til visualisering af intranukleære og cytoplasmatiske mikrotubuli, actin og associerede proteiner, 10 nm filamenter og andre bestanddele af cytoplasma, membran og cellevægge..
Referencer
- Abcam, immuncytokemi og immunfluorescensprotokol. Hentet fra abcam.com
- Greph, C. (2012). Fluorescerende farvestoffer. Hentet fra leica-microsystems.com
- Miller, D. M., & Shakest, D. C. (1995). Immunfluorescensmikroskopi. I Metoder i cellebiologi (Bind 48, s. 365-394). Academic Press, Inc..
- Odell, I. D., & Cook, D. (2013). Immunfluorescensteknikker. Journal of Investigative Dermatology, 133, 1-4.
- Princle, B. J. R., Adams, A. E. M., Druain, D. G., & Brian, K. (1991). Immunfluorescensmetoder til gær. I Metoder til enzymologi (Bind 194, s. 565-602). Academic Press, Inc..
- Schaeffer, M., Orsi, E. V, & Widelock, D. (1964). Anvendelser af immunfluorescens i folkesundhedsvirologi. Bakteriologiske anmeldelser, 28(4), 402-408.
- Vrieling, E. G. og Anderson, D. M. (1996). Immunfluorescens i fytoplanktonforskning: applikationer og potentiale. J: Phycol., 32, 1-16.



Endnu ingen kommentarer