
Jernmetalstruktur, typer, egenskaber

Det jernholdigt metal Det er dem, der indeholder jern (Fe) såvel som små mængder andre metaller, der tilsættes for at give deres legeringer visse gavnlige egenskaber. Selvom jern kan eksistere i forskellige oxidationstilstande, er +2 (jern) og +3 (jern) de mest almindelige.
Udtrykket "jernholdigt" henviser imidlertid til tilstedeværelsen af jern uanset dets oxidationstilstand i materialet. Jern er det fjerde mest forekommende element i jordskorpen, men globalt er det det vigtigste jordelement. Derfor har jernholdige metaller historisk og industrielt haft en rolle i menneskets udvikling..

Dette har været tilfældet på grund af dets store overflod og modificerbare egenskaber. Disse jernholdige metaller starter ved ekstraktion af jern fra mineralogiske kilder, såsom: hæmatit (FetoELLER3), magnetit (Fe3ELLER4) og siderit (FeCO3). På grund af ydeevne er disse oxider mest ønskede i jernforarbejdning.
Det øverste billede viser et glødende støbejern “ildens tunge”. Af alle jernholdige metaller består det vigtigste af en jernlegering med små mængder tilsat kulstof: stål..
Artikelindeks
- 1 Struktur
- 2 Egenskaber og egenskaber
- 3 eksempler
- 3.1 Smedejern eller blødt jern
- 3.2 Råjern eller råjern
- 3.3 Rent jern
- 3.4 Støbejern eller støbejern (støberier)
- 3.5 Gråt jern
- 3.6 Duktilt jern
- 3.7 Stål
- 4 Stål og dets anvendelser
- 4.1 Kulstof eller konstruktionsstål
- 4.2 Siliciumstål
- 4.3 Galvaniseret stål
- 4.4 Rustfrit stål
- 4.5 Manganstål
- 4.6 Invar stål
- 5 Referencer
Struktur
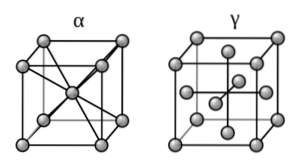
Fordi jern er hovedkomponenten i jernholdige metaller, består deres strukturer af krystallinske deformationer af deres rene faste stof.
Derfor er jernholdige legeringer som stål intet andet end den interstitielle inkludering af andre atomer i krystalarrangementet af jern..
Hvad er dette arrangement? Jern danner allotroper (forskellige faste strukturer) afhængigt af temperaturen, det udsættes for, og ændrer dets magnetiske egenskaber. Således præsenterer den ved stuetemperatur et bcc-arrangement, også kendt som alfa-jern (terningen til venstre, øverste billede).
På den anden side manifesterer det sig i en række høje temperaturer (912-1394 (ºC)) arrangementet ccp eller fcc: jern-gamma (terningen til højre). Når denne temperatur er overskredet, vender jernet tilbage til bcc-formen for endelig at smelte.
Denne ændring i alfa-gamma-struktur er kendt som fasetransformation. Gamma-fasen er i stand til at "fange" kulstofatomer, mens alfafasen ikke er det.
I tilfælde af stål kan dets struktur således visualiseres som sæt jernatomer, der omgiver et carbonatom..
På denne måde afhænger strukturen af jernholdige metaller af fordelingen af jernfaserne og atomerne fra andre arter i det faste stof..
Egenskaber og egenskaber
Rent jern er et blødt og meget duktilt metal, meget følsomt over for korrosion og oxidation fra eksterne faktorer. Men når det inkluderer forskellige andele af et andet metal eller kulstof, får det nye egenskaber og egenskaber..
Faktisk er det disse ændringer, der gør jernholdige metaller nyttige til utallige applikationer..
Jernlegeringer er generelt stærke, holdbare og hårde med lyse grålige farver og magnetiske egenskaber..
Eksempler
Smedejern eller sødt
Det har et kulstofindhold på mindre end 0,03%. Den er sølvfarvet, ruster let og revner internt. Derudover er den duktil og formbar, en god leder af elektricitet og vanskelig at svejse..
Det er den type jernholdigt metal, som mennesket først brugte til fremstilling af våben, redskaber og bygninger. Det bruges i øjeblikket i plader, nitter, trelliser osv. Da det er en god elektrisk leder, bruges den i kernen af elektromagneter.
Råjern eller støbejern
I det oprindelige højovnsprodukt indeholder det 3-4% kulstof og spor af andre grundstoffer såsom silicium, magnesium og fosfor. Dens vigtigste anvendelse er at gribe ind i produktionen af andre jernholdige metaller.
Rent jern
Det er et gråhvidt metal med magnetiske egenskaber. På trods af sin hårdhed er den skør og skør. Dets smeltepunkt er højt (1500 ºC.) Og det oxiderer hurtigt.
Det er en god elektrisk leder, hvorfor det bruges i elektriske og elektroniske komponenter. Ellers nytter det ikke meget.
Støbejern eller støbejern (støberier)
De har et højt kulstofindhold (mellem 1,76% og 6,67%). De er hårdere end stål, men mere skøre. De smelter ved en lavere temperatur end rent jern omkring 1100 ºC.
Da det er støbbart, er det muligt at fremstille stykker i forskellige størrelser og kompleksitet med det. I denne type jern anvendes grå type støbejern, hvilket giver det stabilitet og formbarhed..
De har en højere modstandsdygtighed over for korrosion end stål. De er også billige og tætte. De har fluiditet ved relativt lave temperaturer og er i stand til at fylde formene.
De har også gode kompressionsegenskaber, men er skøre og går i stykker, før de bøjes, så de er ikke egnede til meget detaljerede stykker..
Gråt jern
Det er det mest almindelige støbejern, hvis grå nuance skyldes tilstedeværelsen af grafit. Det har en kulstofkoncentration mellem 2,5% og 4%; derudover indeholder den 1-3% silikone for at stabilisere grafitten.
Det har mange af egenskaberne ved basale støbejern, der er meget flydende. Det er ufleksibelt og bøjes kort før det går i stykker.
Ductil jern
Der tilsættes kulstof i form af sfærisk granit i en koncentration mellem 3,2% og 3,6%. Den sfæriske form af grafit giver den større slagfasthed og smidighed end grå jern, så den kan bruges i detaljerede og kantede designs.
Stål
Kulstofindhold mellem 0,03% og 1,76%. Blandt dets kvaliteter er hårdhed, udholdenhed og modstand mod fysisk indsats. Generelt ruster de let. De er svejselige og kan behandles i smedningen eller mekanisk.
De har også større hårdhed og mindre fluiditet end støbejern. Af denne grund har de brug for høje temperaturer for at strømme i formene..
Stål og dets anvendelser

Der er flere typer stål, hver med forskellige anvendelser:
Kulstof eller konstruktionsstål
Kulstofkoncentrationen kan variere og etablere fire former: blødt stål (0,25% kulstof), halvsødt stål (0,35% kulstof), halvhårdt stål (0,45% kulstof) og hårdt (0,5%).
Det bruges til fremstilling af værktøj, stålplader, jernbanekøretøjer, søm, skruer, biler og både.
Siliciumstål
Også kaldet elektrisk stål eller magnetisk stål. Dens siliciumkoncentration varierer mellem 1% og 5%, Fe varierer mellem 95% og 99%, og kulstof har 0,5%.
Derudover tilsættes mindre mængder mangan og aluminium. Det har stor hårdhed og høj elektrisk modstand. Det bruges til fremstilling af magneter og elektriske transformere.
Galvaniseret stål
Det er belagt med en zinkbelægning, der beskytter den mod rust og korrosion. Derfor er det nyttigt til fremstilling af rørdele og værktøj..
Rustfrit stål
Den har en sammensætning af Cr (14-18%), Ni (7-9%), Fe (73-79%) og C (0,2%). Det er modstandsdygtigt over for oxidation og korrosion. Det bruges til produktion af bestik såvel som skæremateriale.
Manganstål
Dens sammensætning er Mn (10-18%), Fe (82-90%) og C (1,12%). Det er hårdt og slidstærkt. Anvendes på togskinner, pengeskabe og rustning.
Invar stål
Det har 36% Ni, 64% Fe og 0,5% kulstof. Den har en lav ekspansionskoefficient. Det bruges til konstruktion af indikatorskalaer; for eksempel: målebånd.
Referencer
- Whitten, Davis, Peck & Stanley. (2008). Kemi. 8. udgave, CENGAGE Learning.
- Administrator. (19. september 2017). Hvad er jern, hvor kommer det fra, og hvor mange typer jern der er. Hentet den 22. april 2018 fra: termiser.com
- Wikipedia. (2018). Jern. Hentet den 22. april 2018 fra: en.wikipedia.org
- Metaller. Generelle egenskaber. Ekstraktion og klassificering af metaller. Hentet den 22. april 2018 fra: edu.xunta.gal
- Jose Ferrer. (Januar 2018). Metalurgisk karakterisering af jernholdige og ikke-ferreal materialer. Hentet den 22. april 2018 fra: steemit.com
- Essays, Storbritannien. (November 2013). Grundlæggende strukturer af jernholdige metaller. Hentet den 22. april 2018 fra: ukessays.com
- Cdang. (7. juli 2011). Iron Alpha & Iron Gamma. [Figur]. Hentet den 22. april 2018 fra: commons.wikimedia.org
- Włodi. (15. juni 2008). Fletninger i rustfrit stål. [Figur]. Hentet den 22. april 2018 fra: commons.wikimedia.org


Endnu ingen kommentarer