
Karakteristiske mikrofilamenter, struktur, funktioner, patologi
Det mikrofilamenter eller actinfilamenter, er en af de tre grundlæggende komponenter i cytoskelet af eukaryote celler (mikrofilamenter, mikrotubuli og mellemliggende filamenter) og består af små filamenter af et protein kaldet actin (actinpolymerer).
I eukaryoter er de gener, der koder for actinmikrofilamenter, meget konserverede i alle organismer, hvorfor de ofte bruges som molekylære markører til studier af forskellige slags.

Mikrofilamenter er fordelt i hele cytosolen, men er især rigelige i det område, der ligger bag plasmamembranen, hvor de danner et komplekst netværk og forbinder med andre specielle proteiner til dannelse af cytoskelettet..
Mikrofilamentnetværk i cytoplasmaet fra pattedyrceller kodes af to af de seks gener beskrevet for actin, som er involveret i mikrofilamentdynamik og er endda meget vigtige under stamcelledifferentiering.
Mange forfattere er enige om, at mikrofilamenter er de mest forskelligartede, alsidige og vigtige proteiner i cytoskeletet i de fleste eukaryote celler, og det er vigtigt at huske, at disse ikke findes i prokaryote mikroorganismer..
I denne type celler er der derimod filamenter, der er homologe med mikrofilamenter, men som består af et andet protein: MreB-proteinet..
På nuværende tidspunkt menes genet, der koder for dette protein, at være et muligt forfædrenes gen for eukaryot actin. Sekvenshomologien for aminosyrerne, der udgør MreB-proteinet, er imidlertid kun 15% med hensyn til actinsekvensen.
Da de er en grundlæggende del af cytoskeletet, kan enhver fænotypisk defekt i både mikrotubuli og mellemfilamenter og actinmikrofilamenter (cytoskelet) forårsage forskellige cellulære og systemiske patologier.
Artikelindeks
- 1 Egenskaber og struktur
- 1.1 Organisation
- 2 Hvordan dannes actinfilamenter?
- 2.1 Regulering
- 3 funktioner
- 3.1 Eksempel på funktioner i leveren
- 4 Relaterede patologier
- 5 Referencer
Karakteristika og struktur
Mikrofilamenter består af proteinmonomerer af actinfamilien, som er meget rigelige kontraktile proteiner i eukaryote celler, da de også deltager i muskelsammentrækning..
Disse filamenter har en diameter mellem 5 og 7 nm, så de er også kendt som tynde filamenter og består af to former for actin: den kugleform (G actin) og den trådform (F actin)..
Proteinerne, der deltager i cytoskelettet, er kendt som γ- og β-actiner, mens de, der deltager i sammentrækning, normalt er α-actiner..
Andelen af globulært actin og trådformet actin i cytosolen afhænger af cellulære behov, da mikrofilamenter er meget variable og alsidige strukturer, som konstant vokser og forkortes ved polymerisering og depolymerisering..
G actin er et lille kugleprotein, der består af næsten 400 aminosyrer og med en molekylvægt på omkring 43 kDa.
G-actin-monomerer, der udgør mikrofilamenterne, er arrangeret i form af en spiralformet streng, da hver gennemgår et twist, når de er forbundet med den næste.
G-actin associeres med et molekyle Ca2 + og et andet af ATP, som stabiliserer dets kugleform; mens F-actin opnås efter hydrolyse af det terminale phosphat af ATP-molekylet i G-actin, hvilket bidrager til polymerisation.
Organisation
Actin filamenter kan organiseres i "bundter" eller "netværk", der har forskellige funktioner inden i celler. Bundterne danner parallelle strukturer forbundet med temmelig stive tværbroer.
Netværk er derimod løsere strukturer, som tredimensionelle masker med egenskaberne af halvfaste geler..
Der er mange proteiner, der er forbundet med actinfilamenter eller mikrofilamenter og er kendt som ABP (fra engelsk actinbindende proteiner), som har specifikke websteder til det.
Mange af disse proteiner tillader mikrofilamenter at interagere med de to andre komponenter i cytoskelettet: mikrotubuli og mellemliggende filamenter såvel som med de andre komponenter i plasmamembranens indre overflade..
Andre proteiner, som mikrofilamenter interagerer med, inkluderer nukleare laminer og spektrin (i røde blodlegemer).
Hvordan dannes actinfilamenter?
Da kugleformede actinmonomerer altid binder på samme måde, orienteret i samme retning, har mikrofilamenter en defineret polaritet med to ender: en "mere" og en "mindre"..
Polariteten af disse filamenter er meget vigtig, da de vokser betydeligt hurtigere i deres positive ende, hvor de nye G-actin monomerer tilføjes..

Den første ting, der finder sted under polymerisationen af actinfilamenter, er en proces kendt som "kimdannelse", som består af associering af tre monomerer af proteinet.
Nye monomerer føjes til denne trimer i begge ender, så filamentet vokser. G-actinmonomerer er i stand til at hydrolysere ATP med hver binding, hvilket har implikationer for polymerisationshastigheden, da actin-ATP-dele dissocieres med større vanskelighed end actin-ADP-dele..
ATP er ikke nødvendigt til polymerisation, og den specifikke rolle for hydrolysen er endnu ikke belyst..
Nogle forfattere mener, at eftersom actinpolymerisationshændelser hurtigt er reversible, kan ATP forbundet med disse processer repræsentere op til 40% af den samlede cellulære omsætning af dette energimolekyle.
Regulering
Både polymerisationen af actinfilamenter og deres depolymerisation er processer, der er stærkt reguleret af en række specifikke proteiner, som er ansvarlige for omformningen af filamenterne..
Et eksempel på proteiner, der regulerer depolymerisering, er actin-depolymerisationsfaktoren cofilin. Et andet protein, profilin, har en modsat funktion, da det stimulerer associeringen af monomerer (ved at stimulere udvekslingen af ADP mod ATP).
Funktioner
Mikrofilamenter interagerer med myosinfilamenter, der er associeret med transmembranproteiner, der har et domæne i cytosolen og et andet i celleudvendigheden og dermed deltager i processerne med cellemobilitet.
Disse mikrofilamenter associeret med plasmamembranen medierer forskellige cellulære reaktioner på forskellige klasser af stimuli. For eksempel drives celleadhæsion i epitelvæv af transmembranproteiner kendt som cadheriner, som interagerer med mikrofilamenter for at rekruttere responsfaktorer..
Actin filamenter interagerer med mellemliggende filamenter for at få ekstracellulære stimuli til at blive transmitteret til nøglepositioner såsom ribosomer og kromosomer i kernen..
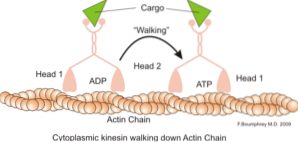
En klassisk og meget undersøgt funktion af mikrofilamenter er deres evne til at danne "broer", "skinner" eller "motorveje" til bevægelse af motorproteinet myosin I, som er i stand til at fylde transportvesikler fra organeller til membranen plasmatisk i sekretet. stier.
Mikrofilamenter interagerer også med myosin II for at etablere den kontraktile ring, der dannes under cytokinese, netop i den sidste fase af celledeling, hvor cytosolen adskilles fra stamceller og datterceller..
Generelt modulerer F-actin mikrofilamenter fordelingen af nogle organeller såsom Golgi-komplekset, endoplasmatisk retikulum og mitokondrier. Derudover deltager de også i den rumlige positionering af mRNA'er, så de læses af ribosomer..
Hele det cellulære sæt mikrofilamenter, især dem, der er tæt beslægtet med plasmamembranen, deltager i dannelsen af de bølgende membraner af celler, der har en konstant aktiv bevægelse.
De er også involveret i dannelsen af mikrovilli og andre almindelige buler på overfladen af mange celler..
Eksempel på funktioner i leveren
Mikrofilamenter deltager i galdesekretionsprocessen i hepatocytter (leverceller) og også i peristaltiske bevægelser (koordineret sammentrækning) af leverkanaliculi.
De bidrager til differentieringen af plasmamembrandomæner takket være deres tilknytning til forskellige cytosoliske elementer og den kontrol, de udøver over topografien af disse intracellulære elementer..
Relaterede patologier
Der er få sygdomme forbundet med primære defekter i strukturen eller med regulerende proteiner og enzymer i syntesen af mikrofilamenter, på trods af at disse er direkte involveret i et stort antal funktioner..
Den lave hastighed af sygdomme og misdannelser i den primære struktur af mikrofilamenter skyldes, at der generelt er flere gener, der koder for både actin og dets regulatoriske proteiner, et fænomen kendt som "genetisk redundans".
En af de mest undersøgte patologier er forglasningen af oocytterne på deres cytoskelet, hvor der observeres en afbrydelse i netværket af kortikale mikrofilamenter samt depolymerisering og desorganisering af mikrotubuli i den mitotiske spindel..
Generelt forårsager denne forglasning en kromosomal dispersion, da den fører til en forstyrrelse i komprimeringen af alt kromatinet.
Cellerne, der har en større organisation og andel af mikrofilamenter i deres cytoskelet, er cellerne i den striede muskel, derfor er de fleste patologier forbundet med en funktionsfejl i det kontraktile apparat.
Defekte eller atypiske mikrofilamenter er også blevet forbundet med knoglesygdommen kendt som Pagets sygdom..
Referencer
- Aguilar-Cuenca, R., Llorente-González, C., Vicente, C. og Vicente-Manzanares, M. (2017). Mikrofilamentkoordineret adhæsionsdynamik driver enkeltcellemigration og former hele væv. F1000 Forskning, 6.
- Dos Remedios, C. G., Chhabra, D., Kekic, M., Dedova, I. V., Tsubakihara, M., Berry, D. A., & Nosworthy, N. J. (2003). Actinbindende proteiner: regulering af cytoskeletale mikrofilamenter. Fysiologiske anmeldelser, 83(2), 433-473.
- Guo, H., Fauci, L., Shelley, M., & Kanso, E. (2018). Bistabilitet i synkroniseringen af aktiverede mikrofilamenter. Journal of Fluid Mechanics, 836, 304-323.
- Lanza, R., Langer, R., & Vacanti, J. P. (red.). (2011). Principper for vævsteknik. Akademisk presse.
- Robbins, J. (2017). Sygdomme i cytoskeletet: Desminopatierne. I kardioskeletale myopatier hos børn og unge voksne (s. 173-192). Akademisk presse.


Endnu ingen kommentarer