
Atom nummer
Hvad er atomnummeret?
Atomnummeret for et kemisk element indikerer antallet af protoner indeholdt i atomkernen af det grundstof. I tilfælde af at det var et neutralt atom, vil atomnummeret falde sammen med antallet af elektroner i elementet.
Som det er kendt, består atomkernen af protoner og neutroner. Protoner har en positiv ladning, og deres værdi falder sammen med den absolutte værdi af elektronens negative ladning, som er 1,6 x 10-19 coulomb i internationale systemenheder.
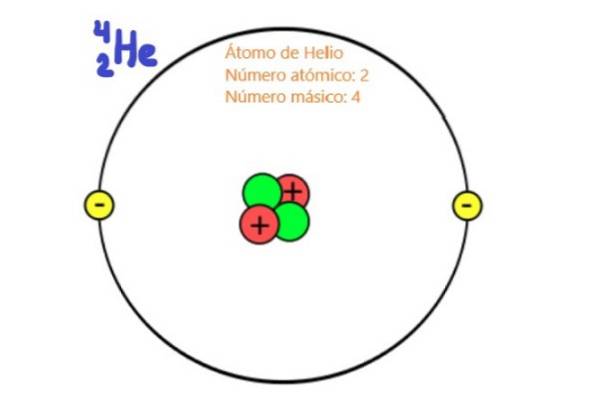
Fordi de er partikler i atomkernen, er protoner og neutroner kendt som nukleoner. Det er disse partikler, der praktisk talt bestemmer atomets masse, da nukleonerne er omkring to tusind gange mere massive end atomerne. Af denne grund kaldes antallet af nukleoner i et atom massenummer.
Men den Atom nummer det er den, der bestemmer atomarelementernes kemiske affinitet, for i neutrale atomer falder dette tal sammen med antallet af elektroner.
Atomisk nummerrepræsentation
I det periodiske system ledsages symbolet X for et kemisk element i nederste venstre side af tallet Z, der repræsenterer atomnummeret for elementet, mens massetallet er angivet øverst til venstre for det kemiske symbol for elementet. TIL.
Følgende figur viser denne notation:
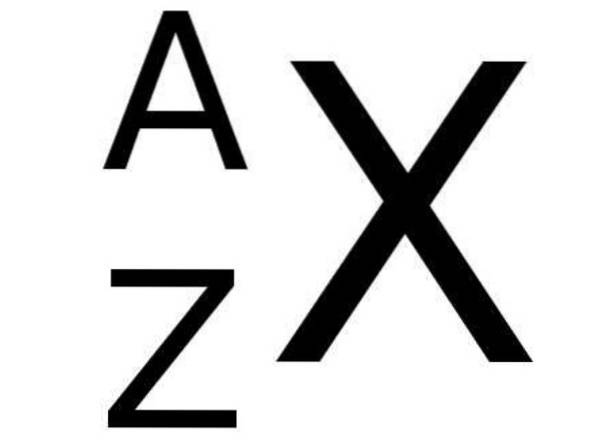
Og nedenfor viser tabel 1 nogle eksempler på kemiske grundstoffer med deres respektive notation og atom- og massetal:
tabel 1
| Element | Notation | Atomnummer Z | Masse nummer A. |
|---|---|---|---|
| Brint | 1 1 H | 1 | 1 |
| Kulstof | 12 6 C | 6 | 12 |
| Ilt | 16 8 ELLER | 8 | 16 |
| Uran | 238 92 ELLER | 92 | 238 |
Atomnummer og rækkefølge af elementer i det periodiske system
Det periodiske system med kemiske grundstoffer tillader det sekventielle arrangement og i stigende rækkefølge af elementerne i henhold til værdien af deres atomnummer.
Mindst 118 af dem er kendt, startende med brint, indtil de når elementet 118, som er det oganeson -før kaldet ununoctium-, hvis kemiske symbol er Og og dets massetal er 294.
De første 10 kemiske grundstoffer med stigende rækkefølge i atomnummer er meget mere velkendte. Så for eksempel har vi det bedst kendte:
- Brint, H
- Helium, han
- Lithium, Li
- Beryllium, vær
- Bor, B
- Kulstof, C
- Kvælstof, N
- Oxygen, O
- Fluor, F
- Neon, Ne

Elektronisk konfiguration
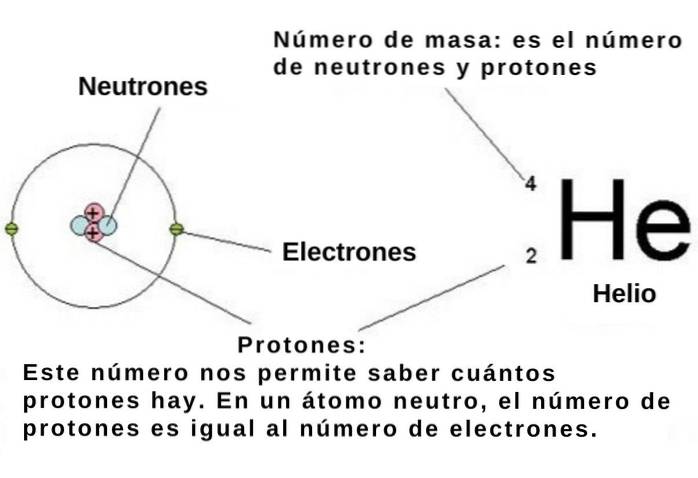
Atomtallet indikerer antallet af protoner i atomkernen af et kemisk element, og hver proton har, som vi har sagt, en elementær positiv ladning på 1.602 x 10-19 C.
Hvis atomet er neutralt, er antallet af elementært negativt ladede elektroner -1,602 x10-19 C skal være lig med atomnummeret. Så ved at kende den numeriske position for et kemisk element i det periodiske system, er dets antal elektroner også kendt..
I atomet besætter disse elektroner regioner, der kaldes orbitaler, som afhænger af elektronens energi og vinkelmoment. Til gengæld kvantiseres både energien og vinkelmomentet for elektronerne i atomet. Dette betyder, at de kun kan tage nogle diskrete værdier.
Nu er orbitalerne befolket med elektroner fra lavere til højere energi efter visse regler, der bestemmer den elektroniske konfiguration.
På denne måde etablerer antallet af elektroner i de yderste orbitaler eller niveauer af et atom de bindinger, som det kan danne med andre atomer for at danne molekyler. Dette tal afhænger af elektronkonfigurationen og atomnummeret.
Kvantumtal
Energien af en elektron i atomet bestemmes af dets vigtigste kvantetal n, som kan tage heltalværdier 1, 2, 3 ...
Elektronens vinkelmoment i atomet bestemmes af det sekundære kvantetal l (bogstav ele) og dens værdier afhænger af n.
For eksempel, for n = 2, tager det sekundære kvantetal værdierne fra 0 til n-1, det vil sige: 0 og 1. Tilsvarende for n = 1, som er det laveste energiniveau, er det sekundære kvantetal l det kun tager værdien 0.
Sekundære kvantetal 0, 1, 2, 3 betegnes skiftevis med bogstaverne s, p, d og f. Orbitalerne er sfæriske, og p-orbitalerne er lobulerede.
Der er to flere kvantetal:
- Det magnetiske kvantetal ml, som tager værdierne fra -l til + l gennem nul.
- Spinkvantantallet s, som kun tager værdier + ½ og -½ og er en egenskab ved elektronen.
Endelig er der Pauli-udelukkelsesprincippet, der siger, at to elektroner ikke kan have alle fire identiske kvantetal. Som en konsekvens af dette princip kan en orbital maksimalt have to elektroner med modsat spin.
Elektronisk konfigurationsdiagram
Elektronkonfigurationsdiagrammet bruges til at kende rækkefølgen af fyldningen af elektronerne fra orbitaler med laveste energi til højeste energi, når atomnummeret for et kemisk element er kendt. Figur 4 viser dette diagram:
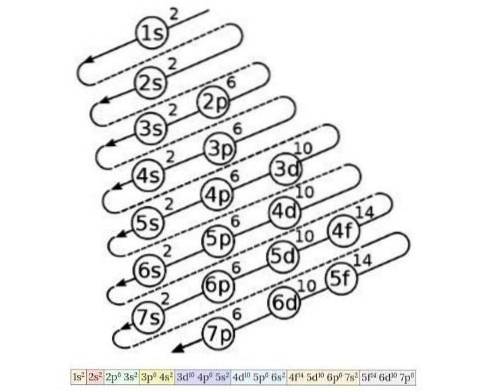
Idéen, der er skitseret der, er følgende: det første tal angiver det vigtigste kvantetal, derefter angiver brevet det sekundære kvantetal, og til sidst angiver overskriftstallet det maksimale antal elektroner, der er muligt i den orbitale..
Eksempel
Elektronisk konfiguration af kulstof og silicium
Som angivet ovenfor har kulstof atomnummer 6, hvilket betyder at det har 6 elektroner, der fordeles som følger: 1s2 2s2 2p2. For sin del har silicium atomnummer 14, og dets elektroner fordeles på denne anden måde: 1s2 2s2 2p6 3s2 3p2.
Begge elementer er i den samme kolonne i det periodiske system, for selvom de har forskellige atomnumre, har de den samme elektroniske konfiguration i det periodiske system. yderste orbital.
Referencer
- Connor, N. Hvad er Nucleon - Atomic Nucleus Structure - Definition. Gendannet fra: periodic-table.org.
- Folketopmødet. Atomnummer: hvad er det, hvordan repræsenteres det. Gendannet fra: cumbrepuebloscop20.org
- Lifeder. Hvad er kemisk periodicitet? Gendannet fra: lifeder.com
- Wikipedia. Elektronisk konfiguration. Gendannet fra: es.wikipedia.com
- Wikipedia. Atom nummer. Gendannet fra: es.wikipedia.com



Endnu ingen kommentarer