
Tør cellestruktur og funktion
EN tør celle det er et batteri, hvis elektrolytiske medium består af en pasta og ikke en opløsning. Den nævnte pasta har dog et bestemt fugtighedsniveau, og af disse grunde er den ikke strengt tør..
Den lille mængde vand er tilstrækkelig til, at ionerne bevæger sig og følgelig strømmen af elektroner inde i cellen..

Dens enorme fordel i forhold til de første våde batterier er, at da det er en elektrolytisk pasta, kan dets indhold ikke spildes; hvilket var tilfældet med våde batterier, som var farligere og delikat end deres tørre kolleger. I betragtning af umuligheden af spild finder den tørre celle anvendelse i mange bærbare og mobile enheder.
På billedet ovenfor er der et tørt zink-carbon-batteri. Mere nøjagtigt er det en moderne version af Georges Leclanché-stakken. Af alle er det den mest almindelige og måske den enkleste.
Disse enheder repræsenterer en energisk bekvemmelighed på grund af det faktum, at de har kemisk energi i lommen, der kan omdannes til elektricitet; og på denne måde ikke afhængig af stikkontakter eller den energi, der leveres af store kraftværker og deres enorme netværk af tårne og kabler.
Artikelindeks
- 1 Struktur af den tørre celle
- 1.1 Elektroder
- 1.2 Terminaler
- 1.3 Sand og voks
- 2 Betjening
- 2.1 Oxidation af zinkelektroden
- 2.2 Reduktion af ammoniumchlorid
- 2.3 Download
- 3 Referencer
Tør cellestruktur
Hvad er strukturen i en tør celle? På billedet kan du se dets dæksel, der ikke er mere end en polymer film, stål og de to terminaler, hvis isolerende skiver stikker frem foran.
Dette er dog kun hans ydre udseende; dens vigtigste dele ligger indeni, hvilket garanterer, at den fungerer korrekt.
Hver tør celle vil have sine egne egenskaber, men kun zink-carbon-cellen vil blive overvejet, hvoraf en generel struktur for alle andre batterier kan skitseres..
Batteri forstås som foreningen af to eller flere batterier, og sidstnævnte er voltaiske celler, som det vil blive forklaret i et fremtidigt afsnit..
Elektroder
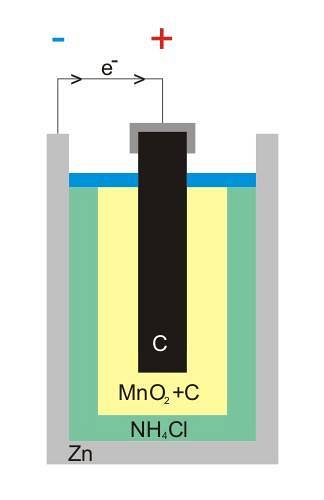
Det øverste billede viser den interne struktur af et zink-carbon-batteri. Uanset hvad den voltaiske celle er, skal der altid (normalt) være to elektroder: en, hvorfra elektroner afgives, og en anden, der modtager dem..
Elektroder er elektrisk ledende materialer, og for at der skal være strøm, skal begge have forskellige elektronegativiteter.
For eksempel er zink, en hvid tin, der omslutter batteriet, hvor elektronerne forlader det elektriske kredsløb (enhed), hvor det er tilsluttet.
På den anden side er den grafitiske kulelektrode i hele mediet; også nedsænket i en pasta sammensat af NH4Cl, ZnClto og MnOto.
Denne elektrode er den, der modtager elektronerne, og bemærk, at den har symbolet '+', hvilket betyder, at det er den positive terminal på batteriet.
Terminaler
Som det ses over grafitstangen på billedet, er der den positive elektriske terminal; og under kan den indre zink kan, hvorfra elektroner strømmer, den negative terminal.
Det er grunden til, at batterierne har '+' eller '-' markeringer for at indikere den rigtige måde at forbinde dem med enheden på og dermed lade den tænde..
Sand og voks
Selvom det ikke vises, er pastaen beskyttet af et buffersand og en voksforsegling, der forhindrer den i at spildes eller komme i kontakt med stålet under mindre mekaniske påvirkninger eller omrøring..
Fungerer
Hvordan fungerer en tør celle? Til at begynde med er det en voltaisk celle, det vil sige, den genererer elektricitet fra kemiske reaktioner. Derfor forekommer der redoxreaktioner i celler, hvor arten vinder eller mister elektroner..
Elektroderne fungerer som en overflade, der letter og tillader udvikling af disse reaktioner. Afhængigt af deres ladninger kan oxidation eller reduktion af arten forekomme.
For bedre at forstå dette forklares kun de kemiske aspekter af zink-carbon-batteriet..
Zinkelektrodeoxidation
Så snart den elektroniske enhed er tændt, frigiver batteriet elektroner ved at oxidere zinkelektroden. Dette kan repræsenteres af følgende kemiske ligning:
Zn => Znto+ + 2e--
Hvis der er meget Znto+ omkring metallet, vil en positiv ladningspolarisering forekomme, så der vil ikke være nogen yderligere oxidation. Derfor er Znto+ skal diffundere gennem pastaen mod katoden, hvor elektronerne kommer ind igen.
Når elektronerne har aktiveret artefakten, vender de tilbage til den anden elektrode: grafitten, for at finde nogle kemiske arter, der "venter" på den..
Ammoniumchloridreduktion
Som tidligere nævnt er der NH i pasta4Cl og MnOto, stoffer, der gør pH-værdien sur. Så snart elektronerne kommer ind, vil følgende reaktioner forekomme:
2NH4+ + 2e- => 2NH3 + Hto
De to produkter, ammoniak og molekylært brint, NH3 og Hto, de er gasser, og derfor kan de "kvælde" batteriet, hvis de ikke gennemgår andre transformationer; såsom følgende to:
Znto+ + 4NH3 => [Zn (NH3)4]to+
Hto + 2MnOto => 2MnO (OH)
Bemærk, at ammonium blev reduceret (fået elektroner) til at blive NH3. Disse gasser blev derefter neutraliseret af pastaens andre komponenter..
Komplekset [Zn (NH3)4]to+ letter diffusion af Zn-ionerto+ mod katoden og forhindrer således, at batteriet ”går i stå”.
Artefaktets eksterne kredsløb fungerer som en bro for elektronerne; ellers ville der aldrig være en direkte forbindelse mellem zinkdåsen og grafitelektroden. På billedet af strukturen repræsenterer dette kredsløb det sorte kabel.
Hent
Tørceller findes i mange varianter, størrelser og arbejdsspændinger. Nogle af dem er ikke genopladelige (primære voltaiske celler), mens andre er (sekundære voltaiske celler).
Zink-carbon-batteriet har en arbejdsspænding på 1,5 V. Deres former ændres baseret på deres elektroder og sammensætningen af deres elektrolytter..
Der vil komme et punkt, hvor al elektrolytten har reageret, og uanset hvor meget zinket oxideres, vil der ikke være nogen arter, der modtager elektronerne og fremmer deres frigivelse..
Derudover kan det være tilfældet, hvor de dannede gasser ikke længere neutraliseres og forbliver udøvende tryk inde i batterierne..
Zink-kul-batterier og andre batterier, der ikke er genopladelige, skal genbruges; da dets komponenter, især nikkel-cadmium-komponenter, er skadelige for miljøet ved forurenende jord og vand.
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Batteriet "Dry-Cell". Gendannet fra: makahiki.kcc.hawaii.edu
- Hoffman S. (10. december 2014). Hvad er et tørbatteri? Gendannet fra: upsbatterycenter.com
- Ukrudt, Geoffrey. (24. april 2017). Hvordan fungerer tørbatterier? Videnskabelig. Gendannet fra: sciencing.com
- Woodford, Chris. (2016) Batterier. Gendannet fra: explainthatstuff.com.



Endnu ingen kommentarer