
Isobariske procesformler, ligninger, eksperimenter, øvelser
I en isobar proces, presset P af et system forbliver konstant. Præfikset "iso" kommer fra græsk og bruges til at betegne, at noget forbliver konstant, mens "baros", også fra græsk, betyder vægt.
Isobariske processer er meget typiske både i lukkede beholdere og i åbne rum og er nemme at lokalisere i naturen. Med dette mener vi, at det er fysiske og kemiske ændringer på jordens overflade eller kemiske reaktioner i beholdere, der er åbne for atmosfæren..
Nogle eksempler opnås ved opvarmning af en ballon fyldt med luft i solen, madlavning, kogende eller frysende vand, damp genereret i kedler eller processen med at hæve en luftballon. Senere vil vi give en forklaring på disse sager.
Artikelindeks
- 1 Formel og ligninger
- 2 eksperimenter
- 2.1 Isobariske processer i den ideelle gas
- 3 eksempler
- 3.1 Kogende vand og madlavning
- 3.2 Frys vandet
- 3.3 Opvarmning af en ballon fyldt med luft i solen
- 3.4 Luftballonen
- 3.5 Kedler
- 4 Løst øvelser
- 4.1 Øvelse 1
- 4.2 Øvelse 2
- 5 Referencer
Formel og ligninger
Lad os udlede en ligning for den isobare proces, forudsat at det undersøgte system er en ideel gas, en model, der er velegnet til næsten enhver gas med mindre end 3 atmosfærer af tryk. De ideelle gaspartikler bevæger sig tilfældigt og optager hele volumenet af det rum, der indeholder dem uden at interagere med hinanden..
Hvis den ideelle gas, der er indesluttet i en cylinder udstyret med et bevægeligt stempel, får lov til at ekspandere langsomt, kan det antages, at dens partikler altid er i ligevægt. Derefter udøver gassen på områdets stempel TIL en styrke F af størrelsesorden:
F = p.A
Hvor s er gasens tryk. Denne kraft udøver arbejde, der producerer en uendelig minimal forskydning dx på stemplet givet af:
dW = Fdx = pA.dx
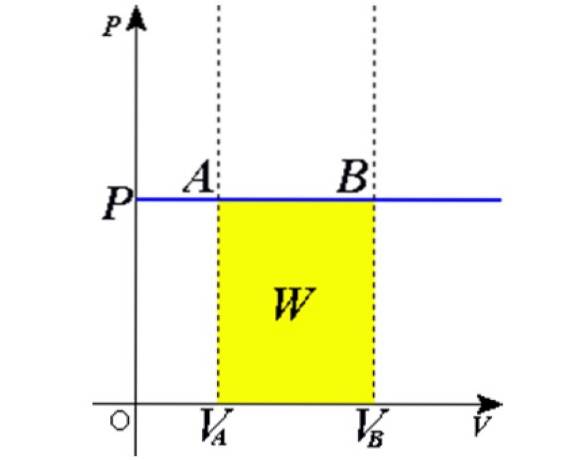
Som produktet Adx er en volumenforskel dV, derefter dW = pdV. Det er stadig at integrere begge sider fra den oprindelige lydstyrke VTIL indtil slutvolumen VB for at få det samlede arbejde udført af gassen:


Eksperimenter
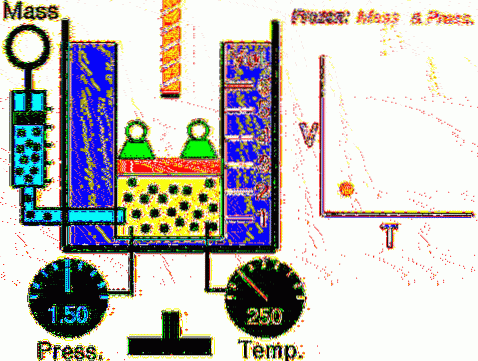
Den beskrevne situation bekræftes eksperimentelt ved at begrænse en gas inde i en cylinder forsynet med et bevægeligt stempel, som vist i figur 2 og 3. En vægt af masse M anbringes på stemplet, hvis vægt er rettet nedad, mens gassen udøver en opadgående kraft takket være trykket P produceret på stemplet.

Da stemplet er i stand til at bevæge sig frit, kan volumenet, som gassen optager, ændre sig uden problemer, men trykket forbliver konstant. Tilføjelse af atmosfærisk tryk Ppengeautomat, som også udøver en nedadgående kraft, har vi:
Mg - P.A + Ppengeautomat . A = konstant
Derfor: P = (Mg / A) + Ppengeautomat det varierer ikke, medmindre M og dermed vægten ændres. Ved at tilføje varme til cylinderen vil gassen ekspandere ved at øge dens volumen, eller den vil trække sig sammen, når den ekstraherer varme..
Isobariske processer i den ideelle gas
Den ideelle gasligning af tilstanden vedrører variablerne af betydning: tryk P, volumen V og temperatur T:
P.V = n. R.T.
Her repræsenterer n antallet af mol, og R er den ideelle gaskonstant (gyldig for alle gasser), som beregnes ved at gange Boltzmanns konstant med Avogadros antal, hvilket resulterer i:
R = 8,31 J / mol K
Når trykket er konstant, kan tilstandsligningen skrives som:
V / T = nR / P
Men nR / P er konstant, da n, R og P er. Så når systemet går fra tilstand 1 til tilstand 2, opstår følgende forhold, også kendt som Charles's lov:
V1/ T1 = Vto/ Tto
Udskiftning i W = PAV, det arbejde, der er udført for at gå fra tilstand 1 til tilstand 2, opnås med hensyn til konstanter og temperaturvariation let at måle med et termometer:
W1 → 2 = nR (T.to - T1) = nR.ΔT
På den anden side siger termodynamikens første lov at:
∆U = Q - W
Dette betyder, at tilføjelse af en vis mængde varme Q til gassen øger den indre energi ∆U og øger vibrationerne i dets molekyler. På denne måde udvides gassen og fungerer ved at flytte stemplet, som vi har sagt før..
I en monatomisk ideel gas og variationen af den indre energi ∆U, som inkluderer både den kinetiske energi og den potentielle energi af dens molekyler, er:
∆U = (3/2)nR AT
Endelig kombinerer vi de udtryk, vi har fået, i et:
Spørgsmål = ∆U + W = (3/2)nR AT + nR∆T = (5/2) nR AT
Alternativt kan Q omskrives med hensyn til massen m, temperaturforskellen og en ny konstant kaldet specifik gasvarme ved konstant tryk, forkortet cs, hvis enheder er J / mol K:
Q = m cs ∆T
Eksempler
Ikke alle isobariske processer udføres i lukkede beholdere. Faktisk forekommer utallige termodynamiske processer af enhver art ved atmosfærisk tryk, så isobariske processer er meget hyppige i naturen. Dette inkluderer fysiske og kemiske ændringer på jordens overflade, kemiske reaktioner i kar, der er åbne for atmosfæren, og meget mere..
For at isobariske processer skal forekomme i lukkede systemer, skal deres grænser være fleksible nok til at tillade volumenændringer uden forskelligt tryk.
Dette var, hvad der skete i stemplets eksperiment, der bevægede sig let, da gassen ekspanderede. Det samme sker ved at omslutte en gas i en festballon eller en luftballon.
Her har vi flere eksempler på isobariske processer:
Kog vand og kog
Kogende vand til te eller madlavning af saucer i åbne beholdere er gode eksempler på isobariske processer, da de alle finder sted ved atmosfærisk tryk..
Når vandet opvarmes, stiger temperaturen og volumenet, og hvis der fortsættes tilsætning af varme, nås kogepunktet endelig, hvor vandets faseændring fra væske til vanddamp opstår. Mens dette sker, forbliver temperaturen også konstant ved 100 ºC..
Frys vandet
På den anden side er frysning af vand også en isobarisk proces, uanset om det finder sted i en sø om vinteren eller hjemmekøleskabet..
Opvarmning af en luftfyldt ballon i solen
Et andet eksempel på en isobarisk proces er ændringen i volumen af en ballon, der pustes op med luft, når den efterlades udsat for solen. Først om morgenen, når den ikke er meget varm endnu, har ballonen et bestemt volumen..
Efterhånden som tiden går, og temperaturen stiger, opvarmes også ballonen og øger dens volumen, og alt dette sker ved konstant tryk. Ballonens materiale er et godt eksempel på en kant, der er fleksibel nok, så luften inde i den, når den opvarmes, udvides uden at ændre trykket.
Oplevelsen kan også udføres ved at justere den ikke-oppustede ballon i tuden på en glasflaske fyldt med en tredjedel vand, der opvarmes i en bain-marie. Så snart vandet er opvarmet, pustes ballonen op med det samme, men man skal passe på ikke at varme for meget, så den ikke eksploderer..
Den aerostatiske ballon
Det er et flydende skib uden fremdrift, der bruger luftstrømme til at transportere mennesker og genstande. Ballonen er normalt fyldt med varm luft, som, når den er koldere end den omgivende luft, stiger og udvider sig, hvilket får ballonen til at stige..
Selvom luftstrømmene dirigerer ballonen, har den brændere, der aktiveres for at varme gassen op, når det ønskes at stige eller opretholde højden, og deaktiveres, når den stiger ned eller lander. Alt dette sker ved atmosfærisk tryk, antaget konstant i en bestemt højde ikke langt fra overfladen..

Kedler
Damp dannes i kedler ved at opvarme vand og holde trykket konstant. Derefter udfører denne damp et brugbart job, for eksempel at generere elektricitet i termoelektriske anlæg eller aktivere andre mekanismer såsom lokomotiver og vandpumper..
Løst øvelser
Øvelse 1
Der er 40 liter gas ved en temperatur på 27 ºC. Find stigningen i volumen, når varme tilsættes isobarisk, indtil den når 100 ºC.
Opløsning
Karls lov bruges til at bestemme det endelige bind, men opmærksomhed: temperaturerne skal udtrykkes i kelvin, blot tilføje 273 K til hver enkelt:
27 ºC = 27 + 273 K = 300 K
100 ºC = 100 + 273 K = 373 K
Fra:
V1/ T1 = Vto/ Tto ⇒ Vto = Tto(V1/ T1) = 373 ºC (40 L / 300 K) = 49,7 L
Endelig er volumenforøgelsen Vto - V1 = 49,7 l - 40 l = 9,7 l.
Øvelse 2
Leveres 5,00 x 103 J af energi til en ideel gas til at udføre 2,00 x 103 J arbejder på sit miljø i en isobarisk proces. Det bliver bedt om at finde:
a) Ændringen i gasens indre energi.
b) Volumenændringen, hvis den interne energi nu falder med 4,50 x 103 J og 7,50 x 10 skubbes ud3 J i systemet under hensyntagen til konstant tryk på 1,01 x 105 Pa.
Løsning til
Brugt ∆U = Q - W og værdierne i erklæringen erstattes: Q = 5,00 x 103 J og W = 2,00 x 103 J:
=5,00 x 103 J - 2,00 x 103 J = 3,00 x 103 J
Derfor stiger gasens indre energi med 3,00 x 103 J.
Løsning b
Volumenændringen findes i det udførte arbejde: W = P∆V:
∆U = Q - W = Q - P∆V
Erklæringen siger, at den interne energi falder, derfor: ∆U= -4,50 x 103 J. Det fortæller os også, at der udvises en vis mængde varme: Q = -7,50 x 103 J. I begge tilfælde repræsenterer det negative tegn fald og tab, så:
-4,50 x 103 J = -7,50 x 103 J - P∆V
Hvor P = 1,01 x 105 Pa. Da alle enheder er i det internationale system, fortsætter vi med at løse volumenændringen:
∆V = (-4,50 x 103 J +7,50 x 103 J) / (- 1,01 x 105 Pa) = -2,97 x 10-to m3
Da volumenændringen er negativ, betyder det, at lydstyrken faldt, dvs. systemet er kontrakt.
Referencer
- Byjou's. Isobarisk proces. Gendannet fra: byjus.com.
- Cengel, Y. 2012. Termodynamik. 7. udgave. Mcgraw bakke.
- Process xyz. Lær mere om den isobariske proces. Gendannet fra: 10proceso.xyz.
- Serway, R., Vulle, C. 2011. Fundamentals of Physics. 9. udgave Cengage Learning.
- Wikipedia. Gaslove. Gendannet fra: es.wikipedia.org.



Endnu ingen kommentarer