
Hvad er elektrondensitet?
Det elektrondensitet det er et mål for, hvor sandsynligt det er at finde elektronen i et givet område af rummet; enten omkring en atomkerne eller i "kvartererne" inden for molekylære strukturer.
Jo højere koncentrationen af elektroner på et givet punkt, jo højere elektrondensitet, og derfor skelnes den fra omgivelserne og udviser visse karakteristika, der forklarer den kemiske reaktivitet. En fremragende og grafisk måde at repræsentere et sådant koncept er gennem elektrostatisk potentiale kort.

For eksempel viser det øverste billede strukturen af S-carnitin-enantiomeren med dets tilsvarende elektrostatiske potentialkort. En skala sammensat af regnbuens farver kan observeres: rød for at indikere regionen med den højeste elektrondensitet og blå for den region, der er ringe med elektroner..
Når molekylet krydses fra venstre mod højre, bevæger vi os væk fra -CO-gruppento- mod skelet CHto-CHOH-CHto, hvor farverne er gule og grønne, hvilket indikerer et fald i elektrondensitet; op til gruppe -N (CH3)3+, den fattigste region af elektroner, farvet blå.
Generelt er de regioner, hvor elektrondensiteten er lav (de farvede gule og grønne) mindst reaktive i et molekyle..
Artikelindeks
- 1 koncept
- 2 Elektrostatisk potentialkort
- 2.1 Farvesammenligning
- 2.2 Kemisk reaktivitet
- 3 Elektrontæthed i atomet
- 4 Referencer
Koncept
Mere end kemisk er elektrondensitet fysisk af natur, fordi elektroner ikke forbliver statiske, men rejser fra den ene side til den anden og skaber elektriske felter..
Og variationen i disse felter forårsager forskellene i elektrondensiteterne i van der Waals-overfladerne (alle disse overflader af kugler).
Strukturen af S-carnitin er repræsenteret af en model af kugler og søjler, men hvis det var ved sin van der Waals overflade, ville søjlerne forsvinde, og kun et sammenklappet sæt kugler ville blive observeret (med de samme farver).
Elektroner er mere tilbøjelige til at være omkring de mere elektronegative atomer; der kan dog være mere end et elektronegativt atom i molekylstrukturen og derfor grupper af atomer, der også udøver deres egen induktive effekt.
Dette betyder, at det elektriske felt varierer mere, end man kan forudsige ved at observere et molekyle set fra et fugleperspektiv; der kan være mere eller mindre polarisering af negative ladninger eller elektrondensitet.
Dette kan også forklares som følger: belastningsfordelingen bliver mere homogen.
Elektrostatisk potentialkort
For eksempel, fordi -OH-gruppen har et oxygenatom, tiltrækker den den elektroniske tæthed af dets nærliggende atomer; i S-carnitin giver det imidlertid en del af sin elektrondensitet til -CO-gruppento-, samtidig med at man forlader gruppen -N (CH3)3+ med større elektronisk mangel.
Bemærk, at det kan være meget vanskeligt at udlede, hvordan induktive effekter virker i et komplekst molekyle, såsom et protein..
For at have et overblik over sådanne forskelle i de elektriske felter i strukturen anvendes beregningsberegningen af de elektrostatiske potentialkort..
Disse beregninger består i at placere en positiv punktladning og flytte den langs overfladen af molekylet; hvor der er mindre elektrondensitet, vil der være elektrostatisk frastødning, og jo højere frastødning, desto mere intens vil den blå farve være.
Hvor elektrondensiteten er højere, vil der være en stærk elektrostatisk tiltrækning repræsenteret af farven rød.
Beregningerne tager højde for alle strukturelle aspekter, dipolmomenterne for bindingerne, de induktive virkninger forårsaget af alle de stærkt elektronegative atomer osv. Og som et resultat får du de farverige og visuelt tiltalende overflader..
Farvesammenligning
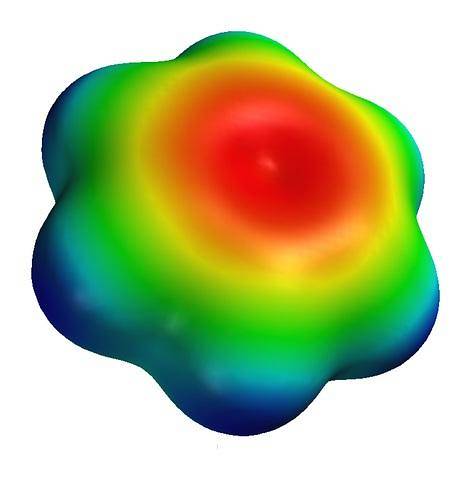
Ovenfor er det elektrostatiske potentialkort for et benzenmolekyle. Bemærk, at der i midten af ringen er en højere elektrondensitet, mens dens "spidser" er blålig på grund af de mindre elektronegative hydrogenatomer. Ligeledes skyldes denne fordeling af ladninger benzens aromatiske karakter.
På dette kort observeres også farverne grøn og gul, hvilket indikerer tilnærmelserne til regionerne fattige og rige på elektroner..
Disse farver har deres egen skala, forskellig fra S-carnitin; og derfor er det forkert at sammenligne gruppen -COto- og midten af den aromatiske ring, begge repræsenteret af farven rød på deres kort.
Hvis de begge holdt den samme farveskala, ville den røde farve på benzenkortet ses som en svag orange. Under denne standardisering kan de elektrostatiske potentialkort, og derfor elektrondensiteterne for forskellige molekyler, sammenlignes..
Ellers ville kortet kun tjene til at kende ladningsfordelingen for et individuelt molekyle..
Kemisk reaktivitet
Ved at observere et kort over elektrostatisk potentiale og derfor regioner med høje og lave elektrontætheder kan det forudsiges (dog ikke i alle tilfælde), hvor kemiske reaktioner vil forekomme i molekylstrukturen..
Regioner med høj elektrondensitet er i stand til at "levere" deres elektroner til omgivende arter, der har behov for eller har brug for dem; til disse arter, negativt ladet, E+, de er kendt som elektrofiler.
Derfor kan elektrofiler reagere med grupperne repræsenteret af farven rød (-COto- og midten af benzenringen).
Mens regioner med lav elektrondensitet reagerer med negativt ladede arter eller med dem, der har gratis par elektroner at dele; sidstnævnte er kendt som nukleofiler.
I tilfælde af -N (CH3)3+, det vil reagere på en sådan måde, at nitrogenatomet vinder elektroner (reducerer).
Elektrontæthed i atomet
I atomet bevæger elektronerne sig med enorme hastigheder og kan være i flere områder af rummet på samme tid.
Når afstanden fra kernen stiger, erhverver elektronerne imidlertid elektronisk potentiel energi, og deres sandsynlige fordeling falder..
Dette betyder, at de elektroniske skyer i et atom ikke har en defineret grænse, men en sløret. Derfor er det ikke let at beregne atomradiusen; Medmindre der er naboer, der etablerer en forskel i afstanden mellem deres kerner, hvoraf halvdelen kan tages som atomradius (r = d / 2).
Atomorbitaler og deres radiale og vinklede bølgefunktioner viser, hvordan elektrondensitet ændres som en funktion af afstanden, der adskiller dem fra kernen..
Referencer
- Reed College. (s.f.). Hvad er elektrondensitet? ROCO. Gendannet fra: reed.edu
- Wikipedia. (2018). Elektrontæthed. Gendannet fra: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (11. juni 2014). Definition af elektrondensitet. Gendannet fra: thoughtco.com
- Steven A. Hardinger. (2017). Illustreret ordliste for organisk kemi: Elektrontæthed. Gendannet fra: chem.ucla.edu
- Kemi LibreTexts. (29. november 2018). Atomiske størrelser og fordeling af elektrondensitet. Gendannet fra: chem.libretexts.org
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10th udgave.). Wiley plus.
- Carey F. (2008). Organisk kemi. (Sjette udgave). Mc Graw Hill.



Endnu ingen kommentarer