
Hvad er spektral notation?
Det spektral notation er arrangementet af elektroner i energiniveauer omkring kernen i et atom. Ifølge den gamle Bohr-atommodel optager elektroner forskellige niveauer i kredsløb omkring kernen, fra den første skal nærmest kernen, K, til den syvende skal, Q, som er længst væk fra kernen..
Med hensyn til en mere raffineret kvantemekanisk model er K-Q-skaller opdelt i et sæt orbitaler, som hver især kan optages af ikke mere end et par elektroner..

Almindeligvis anvendes elektronkonfigurationen til at beskrive et atoms orbitaler i dets jordtilstand, men det kan også bruges til at repræsentere et atom, der er ioniseret til en kation eller anion, hvilket kompenserer for tab eller gevinst af elektroner i deres respektive orbitaler. ..
Mange af grundstoffernes fysiske og kemiske egenskaber kan korreleres med deres unikke elektroniske konfigurationer. Valenselektroner, elektronerne i den yderste skal, er den afgørende faktor for elementets unikke kemi..
Når elektroner i atomets yderste skal modtage energi af en eller anden art, bevæger de sig til lag med højere energi. Således vil en elektron i K-skallen blive overført til L-skallen i en tilstand med højere energi.
Når elektronen vender tilbage til sin jordtilstand, frigiver den den energi, den absorberer ved at udsende et elektromagnetisk spektrum (lys). Da hvert atom har en specifik elektronisk konfiguration, vil det også have et specifikt spektrum, der vil blive kaldt absorptionsspektret (eller emission)..
Af denne grund bruges udtrykket spektral notation til at henvise til elektronkonfigurationen.
Sådan bestemmes spektralnotation: kvantetal
I alt fire kvantetal bruges til fuldt ud at beskrive bevægelse og baner for hver elektron i et atom..
Kombinationen af alle kvantetal for alle elektroner i et atom er beskrevet af en bølgefunktion, der opfylder Schrödinger-ligningen. Hver elektron i et atom har et unikt sæt kvantetal.
Ifølge Pauli-eksklusionsprincippet kan to elektroner ikke dele den samme kombination af fire kvantetal.
Kvantumtal er vigtige, fordi de kan bruges til at bestemme elektronens konfiguration af et atom og den sandsynlige placering af elektronerne i atomet..
Kvantumtal bruges også til at bestemme andre egenskaber ved atomer, såsom ioniseringsenergi og atomradius..
Kvantumnumre betegner specifikke skaller, subshells, orbitaler og spins af elektroner.
Dette betyder, at de fuldt ud beskriver egenskaberne ved en elektron i et atom, det vil sige, at de beskriver hver unikke løsning på Schrödinger-ligningen eller bølgefunktionen af elektroner i et atom..
Der er i alt fire kvantetal: det primære kvantetal (n), det orbitalvinkelmomentkvantumtal (l), det magnetiske kvantetal (ml) og elektronens spinkvantumtal (ms).
Det primære kvantetal, nn, beskriver energien af en elektron og den mest sandsynlige afstand af elektronen fra kernen. Med andre ord henviser det til størrelsen på orbitalen og energiniveauet, hvormed en elektron er placeret..
Antallet af subshells, eller ll, beskriver formen på orbitalen. Det kan også bruges til at bestemme antallet af vinkelknudepunkter.
Det magnetiske kvantetal, ml, beskriver energiniveauerne i en subshell, og ms henviser til centrifugeringen på elektronen, som kan være op eller ned..
Aufbau-princippet
Aufbau kommer fra det tyske ord "Aufbauen", som betyder "at bygge". I det væsentlige bygger vi ved at skrive elektronkonfigurationer elektronorbitaler, når vi bevæger os fra et atom til et andet..
Når vi skriver et atoms elektronkonfiguration, udfylder vi orbitalerne i stigende rækkefølge med atomnummer.
Aufbau-princippet stammer fra Pauli-udelukkelsesprincippet, der siger, at der ikke er to fermioner (fx elektroner) i et atom.
De kan have det samme sæt kvantetal, så de er nødt til at "stable" ved højere energiniveauer. Hvordan elektroner akkumuleres, er et spørgsmål om elektronkonfigurationer.
Stabile atomer har lige så mange elektroner som protoner i kernen. Elektroner samles omkring kernen i kvanteorbitaler efter fire grundlæggende regler kaldet Aufbau-princippet..
- Der er ikke to elektroner i atomet, der deler de samme fire kvantetal n, l, m og s.
- Elektroner optager orbitaler med det laveste energiniveau først.
- Elektronerne udfylder altid orbitalerne med det samme spin-nummer. Når orbitalerne er fulde, begynder det.
- Elektronerne udfylder orbitaler med summen af kvantetallene n og l. Orbitaler med lige værdier på (n + l) udfyldes først med de lavere n-værdier.
Den anden og fjerde regel er dybest set den samme. Et eksempel på regel fire ville være 2p og 3s orbitaler.
En 2p orbital er n = 2 og l = 2 og en 3s orbital er n = 3 og l = 1. (N + l) = 4 i begge tilfælde, men 2p orbital har den laveste energi eller laveste n-værdi og vil fyld før laget 3s.
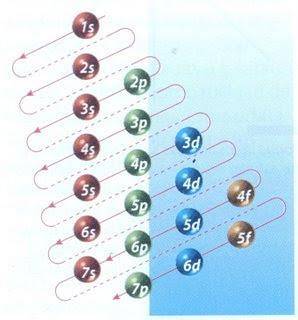
Heldigvis kan Moeller-diagrammet vist i figur 2 bruges til at udfylde elektron. Grafen læses ved at køre diagonalerne fra 1s.
Figur 2 viser atomorbitalerne, og pilene følger vejen frem.
Nu hvor ordenes rækkefølge vides at være udfyldt, er det eneste tilbage at huske størrelsen på hver orbital.
S-orbitaler har 1 mulig værdi på ml at holde 2 elektroner
P-orbitaler har 3 mulige værdier på ml at holde 6 elektroner
D-orbitaler har 5 mulige værdier på ml at rumme 10 elektroner
F-orbitaler har 7 mulige værdier på ml at rumme 14 elektroner
Dette er alt, hvad der er nødvendigt for at bestemme den elektroniske konfiguration af et stabilt atom af et element..
Tag for eksempel elementet nitrogen. Kvælstof har syv protoner og derfor syv elektroner. Den første orbital, der skal udfyldes, er 1s orbitalen. En s orbital har to elektroner, så der er fem elektroner tilbage.
Den næste orbital er 2s orbital og indeholder de næste to. De sidste tre elektroner vil gå til 2p orbitalen, der kan rumme op til seks elektroner.
Hund regler
Aufbau's afsnit diskuterede, hvordan elektroner først fylder orbitaler med den laveste energi og derefter kun bevæger sig op til orbitaler med højest energi, efter at orbitaler med lavest energi er fyldt..
Der er dog et problem med denne regel. Bestemt skal 1s-orbitalerne udfyldes før 2s-orbitalerne, fordi 1s-orbitalerne har en lavere værdi på n og derfor en lavere energi..
Og de tre forskellige 2p orbitaler? I hvilken rækkefølge skal de udfyldes? Svaret på dette spørgsmål involverer Hunds regel.
Hunds regel siger, at:
- Hver bane i et underniveau er besat individuelt, før en bane er dobbelt besat.
- Alle elektroner i individuelt optagne orbitaler har samme spin (for at maksimere det samlede spin).
Når elektroner tildeles orbitaler, søger en elektron først at udfylde alle orbitaler med lignende energi (også kaldet degenererede orbitaler), før de parres med en anden elektron i en halv fuld orbital..
Atomer i jordtilstande har tendens til at have så mange ikke-parrede elektroner som muligt. Når du visualiserer denne proces, skal du overveje, hvordan elektroner udviser samme adfærd som de samme poler i en magnet, hvis de skulle komme i kontakt..
Når negativt ladede elektroner fylder orbitalerne, prøver de først at komme så langt væk fra hinanden som muligt, før de skal parre sig..
Referencer
- Anastasiya Kamenko, T. E. (2017, 24. marts). Kvantumtal. Gendannet fra chem.libretexts.org.
- Aufbau-princippet. (2015, 3. juni). Gendannet fra chem.libretexts.org.
- Elektronkonfigurationer og atomernes egenskaber. (S.F.). Gendannet fra oneonta.edu.
- Encyclopædia Britannica. (2011, 7. september). Elektronisk konfiguration. Gendannet fra britannica.com.
- Helmenstine, T. (2017, 7. marts). Aufbau-princippet - Elektronisk struktur og Aufbau-princippet. Gendannet fra thoughtco.com.
- Hunds regler. (2015, 18. juli). Gendannet fra chem.libretexts.org.
- Spektroskopisk notation. (S.F.). Gendannet fra bcs.whfreeman.com.



Endnu ingen kommentarer