
Endergoniske reaktionsegenskaber, eksempler
EN endergonisk reaktion Det er en, der ikke kan ske spontant, og som også kræver en høj energiforsyning. I kemi er denne energi generelt kalorisk. Den bedst kendte af alle endergoniske reaktioner er endotermiske reaktioner, det vil sige dem, der absorberer varme for at forekomme.
Hvorfor er ikke alle reaktioner spontane? Fordi de går op ad bakke til termodynamikens love: de bruger energi, og de systemer, der dannes af de involverede arter, mindsker deres entropi; til kemiske formål bliver de mere molekylært ordnet.

At bygge en mur er et eksempel på en endergonisk reaktion. Mursten alene komprimerer ikke nok til at danne en solid krop. Dette skyldes, at der ikke er nogen energiforøgelse, der fremmer deres fagforeninger (også afspejlet i deres mulige lave intermolekylære interaktioner).
Så for at bygge muren har du brug for cement og en arbejdsstyrke. Dette er energi, og den ikke-spontane reaktion (muren bygges ikke automatisk) bliver mulig, hvis der opfattes en energifordel (økonomisk, i tilfælde af muren).
Hvis der ikke er nogen fordel, vil væggen kollapse under enhver forstyrrelse, og dens mursten vil aldrig være i stand til at holde sammen. Det samme gælder for mange kemiske forbindelser, hvis byggesten ikke spontant kan komme sammen..
Artikelindeks
- 1 Kendetegn ved en endergonisk reaktion
- 1.1 Øger systemets frie energi
- 1.2 Dine produktlinks er svagere
- 1.3 Det er forbundet med exergoniske reaktioner
- 2 Eksempler
- 2.1 Fotosyntese
- 2.2 Syntese af biomolekyler og makromolekyler
- 2.3 Dannelse af diamanter og tunge forbindelser fra råolie
- 3 Referencer
Karakteristik af en endergonisk reaktion
Hvad hvis væggen kan bygges spontant? For dette skal vekselvirkningerne mellem murstenene være meget stærke og stabile, så meget at ingen cement eller en person behøver at bestille dem; mens mur er, selvom den er modstandsdygtig, den hærdede cement, der holder dem sammen og ikke korrekt murstenets materiale.
Derfor er de første egenskaber ved en endergonisk reaktion:
-Det er ikke spontant
-Absorberer varme (eller anden energi)
Og hvorfor absorberer det energi? Fordi dets produkter har mere energi end de reaktanter, der er involveret i reaktionen. Dette kan repræsenteres ved følgende ligning:
ΔG = GProdukter-GReagenser
Hvor ΔG er ændringen i Gibbs fri energi. Ligesom GProdukt er større (fordi den er mere energisk) end GReagenser, subtraktionen skal være større end nul (ΔG> 0). Følgende billede opsummerer yderligere, hvad der netop er blevet forklaret:
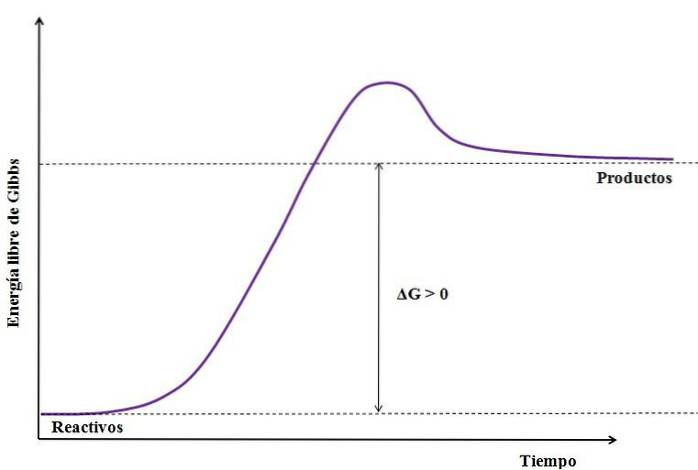
Bemærk forskellen mellem energitilstande mellem produkterne og reaktanterne (lilla linje). Derfor bliver reaktanter ikke produkter (A + B => C), hvis der først ikke er nogen varmeabsorption..
Øger systemets frie energi
Endergonic reaktion er forbundet med en stigning i Gibbs frie energi i systemet. Hvis det for en bestemt reaktion er tilfreds med, at ΔG> 0, vil det ikke være spontant og kræve, at der udføres en energiforsyning.
Hvordan ved man matematisk, hvis en reaktion er endergonisk eller ej? Anvendelse af følgende ligning:
ΔG = ΔH-TΔS
Hvor ΔH er reaktionens entalpi, dvs. den samlede frigivne eller absorberede energi; ΔS er entropiændringen, og T er temperaturen. TΔS-faktoren er tabet af energi, der ikke bruges til ekspansion eller arrangement af molekylerne i en fase (fast, flydende eller gas).
Således er ΔG den energi, som systemet kan bruge til at udføre arbejde. Da ΔG har et positivt tegn for en endergonisk reaktion, skal der påføres energi eller arbejde på systemet (reaktanterne) for at opnå produkterne.
Derefter er det muligt at vide om værdierne af ΔH (positiv, for en endoterm reaktion og negativ for en exoterm reaktion) og TΔS, om reaktionen er endergonisk. Dette betyder, at selvom en reaktion er endoterm, ikke det er nødvendigvis endergonisk.
Isterningen
For eksempel smelter en isterning i flydende vand og absorberer varme, hvilket hjælper med at adskille dens molekyler. processen er imidlertid spontan, og derfor er den ikke en endergonisk reaktion.
Og hvad med situationen, hvor du vil smelte isen ved en temperatur langt under -100ºC? I dette tilfælde bliver TΔS-udtrykket i den frie energiligning lille sammenlignet med ΔH (fordi T falder), og som et resultat vil ΔG have en positiv værdi.
Med andre ord: smeltning af is under -100ºC er en endergonisk proces, og den er ikke spontan. Et lignende tilfælde er at fryse vandet omkring 50 ° C, hvilket ikke sker spontant..
Dine produktlinks er svagere
Et andet vigtigt kendetegn, også relateret til ΔG, er energien i de nye bindinger. Båndene til de dannede produkter er svagere end reaktanterne. Imidlertid kompenseres faldet i bindingenes styrke af en gevinst i masse, hvilket afspejles i de fysiske egenskaber.
Her begynder sammenligningen med murstensvægten at miste betydning. I henhold til ovenstående skal bindingerne inden for murstenene være stærkere end dem mellem dem og cementen. Væggen som helhed er dog mere stiv og modstandsdygtig på grund af dens større masse..
Noget lignende vil blive forklaret i afsnittet eksempler, men med sukker.
Det er kombineret med exergoniske reaktioner
Hvis endergoniske reaktioner ikke er spontane, hvordan foregår de i naturen? Svaret skyldes koblingen med andre reaktioner, der er ret spontane (exergoniske), og som på en eller anden måde fremmer deres udvikling..
For eksempel repræsenterer følgende kemiske ligning dette punkt:
A + B => C (endergonisk reaktion)
C + D => E (exergonisk reaktion)
Den første reaktion er ikke spontan, så den kunne naturligvis ikke forekomme. Produktionen af C tillader imidlertid, at den anden reaktion finder sted og forårsager E.
Tilføjelse af Gibbs frie energier til de to reaktioner, ΔG1 og AGto, med et resultat mindre end nul (ΔG<0), entonces el sistema presentará un incremento de la entropía y por lo tanto será espontáneo.
Hvis C ikke reagerede med D, kunne A aldrig danne det, fordi der ikke er nogen energikompensation (som i tilfælde af penge med murstensvæggen). Det siges derefter, at C og D "trækker" A og B til at reagere, selvom det er en endergonisk reaktion..
Eksempler

Fotosyntese
Planter bruger solenergi til at skabe kulhydrater og ilt fra kuldioxid og vand. COto migto, små molekyler med stærke bindinger, danner sukkerarter med ringstrukturer, som er tungere, mere faste og smelter ved en temperatur på omkring 186 ºC..
Bemærk, at C-C, C-H og C-O obligationer er svagere end dem af O = C = O og O = O. Og fra en sukkerenhed kan planten syntetisere polysaccharider, såsom cellulose.
Syntese af biomolekyler og makromolekyler
Endergoniske reaktioner er en del af anabolske processer. Ligesom kulhydrater kræver andre biomolekyler, såsom proteiner og lipider, komplekse mekanismer, der uden dem og kobling med hydrolysereaktionen af ATP ikke kunne eksistere.
Ligeledes er metaboliske processer såsom cellulær respiration, diffusion af ioner gennem cellemembraner og transport af ilt gennem blodbanen eksempler på endergoniske reaktioner..
Dannelsen af diamanter og tunge forbindelser fra råolie
Diamanter kræver enorme tryk og temperaturer, så deres komponenter kan komprimeres til et krystallinsk fast stof..
Imidlertid er nogle krystallisationer spontane, selvom de forekommer i meget lave hastigheder (spontanitet har ingen relation til reaktionens kinetik).
Endelig repræsenterer råolie et produkt af endergoniske reaktioner, især tunge kulbrinter eller makromolekyler kaldet asfaltener..
Deres strukturer er meget komplekse, og deres syntese tager lang tid (millioner af år), varme og bakteriel handling..
Referencer
- QuimiTube. (2014). Endergoniske og exergoniske reaktioner. Gendannet fra: quimitube.com
- Khan Academy. (2018). Gratis energi. Gendannet fra: es.khanacademy.org
- Biologi ordbog. (2017). Definition af endergonisk reaktion. Gendannet fra: biologydictionary.net
- Lougee, Mary. (18. maj 2018). Hvad er en endergonisk reaktion? Videnskabelig. Gendannet fra: sciencing.com
- Helmenstine, Anne Marie, Ph.D. (22. juni 2018). Endergonic vs Exergonic (med eksempler). Gendannet fra: thoughtco.com
- Arrington D. (2018). Endergonic reaktion: definition og eksempler. Undersøgelse. Gendannet fra: study.com
- Audersirk Byers. (2009). Livet på jorden. Hvad er energi? [PDF]. Gendannet fra: hhh.gavilan.edu



Endnu ingen kommentarer