
Safranin karakteristika, anvendelse, teknikker, toksicitet
Det safranin Det er et meriquinoidfarvestof, der er opkaldt efter at have i sin kemiske struktur 2 benzenoidringe og 2 quinoidringe, hvor sidstnævnte er dem, der giver den røde farve.
Det kaldes også dimethylsafranin eller basisk rød 2 i sin korte form, da dets videnskabelige navn er 3,7-diamino-2,8-dimethyl-5-phenyl-phenaziniumchlor-dimethylsafranin og den kemiske formel er CtyveH19N4 Cl.
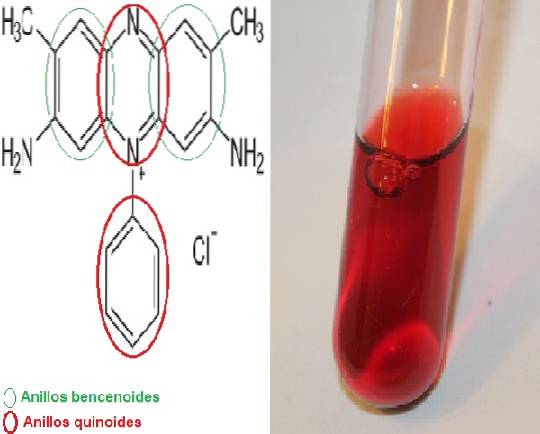
Der er en variant kaldet trimethyl-safranin, men der er ingen signifikant forskel mellem de to stoffer.
Safranin er et monokromatisk farvestof, og afhængigt af egenskaberne ved den kemiske formel er det et positivt ladet stof. Derfor har det en affinitet for negativt ladede strukturer. Disse strukturer farves rødt.
Denne egenskab giver det anvendelighed i mange histologiske teknikker til at plette forskellige cellulære strukturer, både i eukaryote og prokaryote organismer..
Safranin bruges som kontrastfarvestof i vigtige og velkendte teknikker til rutinemæssig brug inden for bakteriologi. Disse teknikker er: Gram-Hucker-pletten, Schaeffer Fulton-pletten til sporer eller farvning af bakteriekapsler, blandt andre..
Artikelindeks
- 1 Funktioner
- 2 Brug
- 3 Teknikker inden for bakteriologi
- 3.1 Castañeda-plet til rickettsial-farvning
- 3.2 Modificeret Koster-plet til Brucella
- 3.3 Farvning af bakteriekapsler
- 3.4 Schaeffer Fulton sporefarvning
- 3,5 Gram-Hucker-plet
- 4 teknikker inden for histologi
- 4.1 Kulchitsky-cellefarvning (enterokromaffiner)
- 4.2 Farvning til påvisning af slidgigt
- 4.3 Farvning til identifikation af makroalger
- 5 Toksicitet
- 6 Referencer
Egenskaber
Farven på safran (et krydderi opnået ved stigmatiseringen af blomsten af Crocus sativus) var inspirationen til at navngive denne farve. Fra udtrykket safran kommer navnet safranin. Dette skyldes den store lighed mellem safranfarven og farven, som dette farvestof giver..
Safranin opnås som krystaller eller i pulver, idet begge præsentationer er opløselige i vand. Safraninfarvestoffet er lugtfrit. Pletter strukturer røde. De strukturer, der tiltrækker safraninfarvestof, kaldes safranofiler..
Strukturelt er safranin kompleks, den har to benzenoidringe i enderne og i midten er de to quinoidringe, hvor N-kationen findes.+. Midten af strukturen er det system, der har ansvaret for at give farven. På grund af denne egenskab er dette farvestof klassificeret i kategori II..
Brug
Safranin bruges til at plette forskellige strukturer. Især fremhæver Kulchitsky-cellerne i mave-tarmkanalen, også kaldet enterochromaffin-celler.
Det er i stand til at farve mikroorganismer, der hører til familien Rickettsiaceae. Ligeledes bruges den i forskellige teknikker, såsom Koster-metoden, en modificeret anvendt til farvning af bakterier af slægten Brucella.
På den anden side anvendes safranin i Schaeffer Fulton-sporfarvningsteknikken og i Gram-Hucker-farvning. I begge teknikker fungerer safranin som et kontrastfarvestof.
I den første tager sporer farven på malakitgrøn, og resten af strukturer er røde af safranin. I det andet mister de gramnegative bakterier farven på den violette krystal i misfarvningstrinet, derfor er safranin den, der pletter de gramnegative bakterier rødt.
Derudover anvendes safranin i bakteriologi til at forberede Brucella-agarmedier med en 1: 5000 fortynding af safranin. Dette medium tjener til at differentiere arten Brucella suis af resten af arten. Brucella melitensis Y Brucella abortus de vokser i dette miljø, men B. suis er hæmmet.
På det agroindustrielle område er safranin blevet anvendt ved 2,25% og fortyndet 1:10 til pletprøver af sukkerrørplanten.
Denne plante påvirkes ofte af bakterierne Leifsonia xyli subsp. xyli, der beskadiger plantens xylem. De farvede stængler evalueres for at bestemme funktionen af xylem-karene..
Teknikker inden for området bakteriologi
Castañeda-plet til r-farvningickettsiae
Et blod- eller vævsudstrygning anbringes i en bufferopløsning (phosphatbuffer pH 7,6). Det får lov til at tørre spontant og derefter dækket med methylenblåt i 3 minutter og modfarvet med safranin. Rickettsiae er farvet blå i kontrast til den røde baggrund.
Koster plet modificeret til Brucella
Et udstrygning er lavet og flammet i tænderen til fiksering. Derefter dækkes den med en blanding af 2 dele vandig safranin mættet med 3 dele 1 mol / L KOH-opløsning i 1 minut. Det vaskes med destilleret vand og modfarves med 1% carbolisk methylenblåt..
Hvis prøven indeholder bakterier af slægten Brucella disse vises orange på en blå baggrund.
Bakteriel kapselfarvning
En blanding af bakteriesuspension er fremstillet med blæk fra Indien og safranin tilsættes til den. Under mikroskopet observeres en rødlig glorie omkring hver bakteriekapsel med sort baggrund..
Sporfarvning Schaeffer Fulton
En udtværing fremstilles med bakteriesuspensionen. Derefter er det fastgjort til varme. Det er dækket med 5% malakitgrøn, ofte flammende, indtil der udsendes røg. Processen gentages i 6-10 minutter. Endelig vaskes det med vand og modfarves med 0,5% safranin i 30 sekunder. Baciller pletter rødt og sporer grønne.
Gram-Hucker plet
En udtværing er lavet med bakteriesuspension, og den er fastgjort til varme. Dæk objektglasset med krystalviolet i 1 minut. Derefter placeres lugol som en mordant løsning i 1 minut. Derefter bleges det med acetonealkohol og modfarves til sidst med safranin i 30 sekunder..
Grampositive bakterier pletter blålig lilla og gramnegative bakterier rød.
Nogle laboratorier er stoppet med at bruge Gram-Hucker-teknikken til at vedtage den modificerede Gram-Kopeloff-teknik. I sidstnævnte erstattes safranin med grundlæggende fuchsin. Dette skyldes, at safranin svagt pletter arter af slægterne Legionella, Campylobacter Y Brucella.
Teknikker inden for histologi
Kulchitsky-cellefarvning (enterokromaffiner)
Vævsafsnit fra mave-tarmkanalen farves med sølvchlorid. Derefter affarves det med natriumthiosulfat og modfarves til sidst med safranin.
Kulchitsky-celler er kendetegnet ved tilstedeværelsen af sortbrune granulater..
Slidgigt pletter
Fordi safranin har en positiv ladning, binder det meget godt til carboxyl- og sulfatgrupperne af glycosaminoglycaner. Disse er en del af proteoglycaner, der udgør ledbrusk. I denne forstand er det, når der farves med safranin O, muligt at identificere, om der er tab af brusk eller ej..
Tabet af bruskvæv kan måles ved hjælp af Mankin-skalaen eller også kaldet slidgigtskalaen..
Teknikken forklares nedenfor: Den histologiske sektion nedsænkes i en bakke med Weigerts jernhæmatoxylinopløsning, føres derefter gennem sur alkohol og vaskes med vand.
Fortsæt farvningsprocessen ved at nedsænke objektglasset i hurtigt grønt, det vaskes med eddikesyre, og nu nedsænkes det i safranin O. For at afslutte processen dehydreres det ved hjælp af alkoholer i forskellige koncentrationer i stigende rækkefølge. Det sidste trin kræver xylen eller xylol for at prøven kan afklare.
Objektglassene er konditioneret med Canada balsam eller lignende, der skal observeres under et mikroskop..
Med denne teknik farves kernerne sorte, knoglegrønne og brusken, hvor proteoglykanerne findes røde.
Plet til identifikation af makroalger
Pérez et al. I 2003 foreslog en enkel og billig teknik til farvning af makroalger. Prøverne fremstilles i parafinhistologiske sektioner. Sektionerne er fikseret med 1% glycerin, så de kan tørre helt. Derefter anbringes den i xylol for at fjerne paraffinen.
Sektionen rehydratiseres ved at føre den gennem en række bakker indeholdende ethanol i forskellige koncentrationsgrader (faldende rækkefølge) i 2 minutter i hver..
Derefter farves den i 5 minutter med en 3: 1 blanding af 1% safranin med 1% toluidinblåt, begge fremstillet med 50% ethanol. Tre dråber pikrinsyre tilsættes til blandingen, der fungerer som en mordant..
Derefter tørres det ud ved at gå gennem alkoholbakkerne igen, men denne gang stigende. Endelig skylles det med xylol, og prøven fremstilles med Canada balsam, der skal observeres..
Toksicitet
Heldigvis er safranin et farvestof, der ikke udgør en fare for dem, der håndterer det. Det er et harmløst farvestof, det er ikke kræftfremkaldende, og det er ikke brandfarligt..
Direkte kontakt med huden eller slimhinderne kan forårsage en let rødme i området uden større komplikationer. Til dette anbefales det at vaske det berørte område med rigeligt vand.
Referencer
- García H. Safranin-farvestof O. Sundhedstekniker, 2012; 1 (2): 83-85. Tilgængelig på: medigraphic.com
- Gil M. Gram-plet: fundament, materialer, teknik og anvendelser. 2019. Tilgængelig på: lifeder.com
- Gil M. Spore-farvning: begrundelse, teknikker og anvendelser. 2019. Tilgængelig på: lifeder.com
- Safranina. " Wikipedia, The Free Encyclopedia. 7. mar 2017, 10:39 UTC. 3. august 2019, 20:49 da.wikipedia.org
- Pérez-Cortéz S, Vera B, Sánchez C. Nyttig farveteknik i den anatomiske fortolkning af Gracilariopsis tenuifrons Y Gracilaria chilensis (Rhodophyta). Protokol Bot. Venez. 2003; 26 (2): 237-244. Tilgængelig på: scielo.org.
- Iglesia Aleika, Peralta Esther Lilia, Alvarez Elba, Milián J, Matos Madyu. Forholdet mellem funktionerne i xylem-karene og tilstedeværelsen af Leifsonia xyli subsp. xyli. Præsten Veg Beskyttelse. 2007; 22 (1): 65-65. Fås på: scielo.sld



Endnu ingen kommentarer