
Amorf fast struktur, egenskaber, eksempler
Det amorfe faste stoffer Det er dem, der ikke har en lang rækkefølge ordnet struktur. De er det modsatte af hvad der er kendt som et krystallinsk fast stof. Dens partikler er forbundet på en uordnet måde, svarende til væskernes, men med tilstrækkelig kraft til at smelte sammen til en fast struktur..
Denne amorfe karakter er mere almindelig, end du måske tror; det er faktisk en af de mulige tilstande, som kondenseret materiale kan vedtage. Med dette forstås det, at enhver forbindelse, der er i stand til at størkne og derfor krystalliserer, også kan agglomerere på en uordnet måde, hvis de eksperimentelle betingelser tillader det..

Det ovennævnte gælder normalt for rene stoffer, uanset om de er grundstoffer eller forbindelser. Men det er også gyldigt i tilfælde af blandinger. Mange faste blandinger er amorfe, såsom sukkerspind, chokolade, mayonnaise eller kartoffelmos..
Det faktum, at et fast stof er amorft, gør det ikke mindre værdifuldt end et krystallinsk. Strukturel forstyrrelse giver det undertiden unikke egenskaber, som den ikke ville udvise i en krystallinsk tilstand. For eksempel foretrækkes amorf silicium i den fotovoltaiske industri frem for krystallinsk til visse små applikationer.
Artikelindeks
- 1 Struktur af amorfe faste stoffer
- 2 egenskaber
- 3 Forberedelse
- 4 Eksempler på amorfe faste stoffer
- 4.1 Mineraler og plast
- 4.2 Biologisk væv
- 4.3 Briller
- 4.4 Kulstof og metaller
- 5 Referencer
Struktur af amorfe faste stoffer
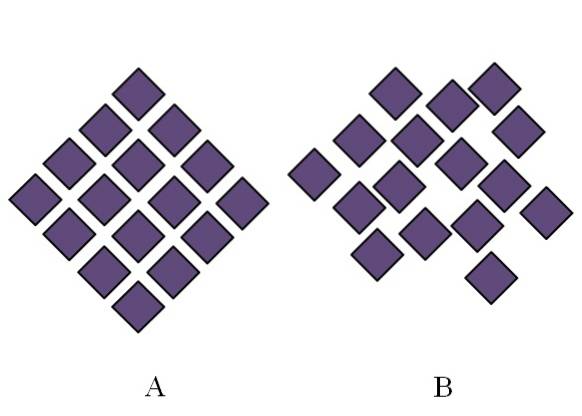
Strukturen af et amorft fast stof er rodet; det mangler periodicitet eller strukturelt mønster. Billedet ovenfor illustrerer dette punkt. A svarer til et krystallinsk fast stof, mens B repræsenterer et amorft fast stof. Bemærk, at i B er de lilla diamanter arrangeret vilkårligt, selvom både i A og B der er den samme type interaktioner.
Hvis B også observeres, vil det ses, at der er mellemrum, der ser ud til at være tomme; det vil sige strukturen har mangler eller uregelmæssigheder. Derfor skyldes en del af den mikroskopiske eller indre forstyrrelse af et amorft fast stof, at dets partikler er "arrangeret" på en sådan måde, at den resulterende struktur har mange ufuldkommenheder..
Først blev der nævnt omfanget af rækkefølgen af amorfe faste stoffer. I B er der kun et par romber, der ser ud til at være pænt justeret. Der kan bestilles regioner; men kun inden for kort rækkevidde.
Et amorft fast stof siges derefter at bestå af umålelige små krystaller med forskellige strukturer. Summen af alle disse strukturer ender med at blive labyrintisk og meningsløs: den globale struktur bliver amorf og består af endeløse krystallinske blokke spredt overalt..
Ejendomme
Egenskaberne af et amorft fast stof varierer afhængigt af arten af dets bestanddele. Der er dog visse generelle egenskaber, der kan nævnes. Amorfe faste stoffer kan være glasagtige, når de præsenterer lignende aspekter som krystaller; eller gelatinøs, harpiksagtig eller støvet.
Da deres strukturer er uordnede, genererer de ikke pålidelige røntgendiffraktionsspektre, ligesom deres smeltepunkter ikke er præcise, men dækker snarere en række værdier..
For eksempel kan smeltepunktet for et amorft fast stof variere fra 20 til 60 ° C. I mellemtiden smelter krystallinske faste stoffer ved en bestemt temperatur eller i et snævert interval, hvis de indeholder mange urenheder..
Et andet kendetegn ved amorfe faste stoffer er, at når de går i stykker eller brister, producerer de ikke geometriske fragmenter med flade ansigter, men uregelmæssige fragmenter med buede ansigter. Når de ikke er glasagtige, fremstår de som støvede og uigennemsigtige kroppe.
Forberedelse
I stedet for et amorft fast stof skal dette koncept behandles som en 'amorf tilstand'. Alle forbindelser (ioniske, molekylære, polymere, metalliske osv.) Er i en vis grad i stand til, og hvis eksperimentelle betingelser tillader det, at danne amorfe og ikke-krystallinske faste stoffer..
F.eks. Opnås i organiske synteser oprindelige faste forbindelser som pulverformige masser. Dens indhold af urenheder er så højt, at de påvirker dens molekylære rækkefølge på lang vej. Derfor, når produktet omkrystalliserer igen og igen, bliver det faste stof mere og mere krystallinsk; det mister sin amorfe karakter.
Dette betyder imidlertid ikke, at amorfe faste stoffer nødvendigvis er urene materialer; flere af dem er amorfe af deres egen kemiske natur.
Et rent stof kan størkne amorft, hvis dets væske pludselig afkøles på en sådan måde, at dets partikler ikke krystalliserer, men antager en glasagtig konfiguration. Afkøling er så hurtig, at partiklerne ikke har tid nok til at rumme de krystallinske blokke, der næppe formår at "blive født".
Vand er for eksempel i stand til at eksistere i en glasagtig, amorf tilstand og ikke kun som is.
Eksempler på amorfe faste stoffer
Mineraler og plast

Næsten ethvert krystallinsk materiale kan tilpasse sig en amorf form (og omvendt). Dette sker med nogle mineraler, som af geokemiske grunde ikke formelt kunne etablere deres konventionelle krystaller. Andre danner derimod ikke krystaller, men glas; sådan er tilfældet med obsidian.
På den anden side har polymerer en tendens til at størkne amorft, da deres molekyler er for store til at definere en ordnet struktur. Det er her blandt andet harpikser, gummi, polystyrenskum (anime), plast, teflon, bakelit kommer ind..
Biologisk væv
Biologiske faste stoffer er for det meste amorfe, såsom: organvæv, hud, hår, hornhinde osv. Ligeledes danner fedt og proteiner amorfe masser; som dog med korrekt forberedelse kan krystallisere (DNA-krystaller, proteiner, fedtstoffer).
Briller

Selv om det er blevet efterladt næsten sidst, er det mest repræsentative amorfe faste glas i sig selv. Dens sammensætning er i det væsentlige den samme som for kvarts: SiOto. Både kvartskrystal og glas er tredimensionelle kovalente netværk; kun at glasgitteret er rodet med Si-O-bindinger af forskellige længder.

Glas er det væsentlige amorfe faste stof, og materialer, der får et lignende udseende, siges at have en glasagtig tilstand..
Kulstof og metaller
Vi har amorft kul, idet aktivt kul er et af de vigtigste på grund af dets absorberende kapacitet. Ligeledes er der amorft silicium og germanium med elektroniske applikationer, hvor de fungerer som halvledere..
Og endelig er der amorfe legeringer, der ikke etablerer en krystallinsk struktur på grund af forskellen mellem deres metalatomer..
Referencer
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Rachel Bernstein og Anthony Carpi. (2020). Egenskaber for faste stoffer. Gendannet fra: visionlearning.com
- Wikipedia. (2020). Amorft fast stof. Gendannet fra: en.wikipedia.org
- Richard Zallen, Ronald Walter Douglas m.fl. (31. juli 2019). Amorft fast stof. Encyclopædia Britannica. Gendannet fra: britannica.com
- Elsevier B.V. (2020). Amorft fast stof. ScienceDirect. Gendannet fra: sciencedirect.com
- Danielle Reid. (2020). Amorft fast stof: definition og eksempler. Undersøgelse. Gendannet fra: study.com
- Rubiks terningskunst. (2008). Hvad er et amorft materiale? Gendannet fra: web.physics.ucsb.edu


Endnu ingen kommentarer