
Kobbersulfidstruktur, egenskaber, anvendelser

Det kobbersulfid er en familie af uorganiske forbindelser, hvis generelle kemiske formel er CuxSY. Ja x Det er større end Y det betyder, at sulfidet er rigere på kobber end svovl; og hvis tværtimod, x Det er mindre end Y, så er svovl rigere på svovl end kobber.
Talrige mineraler dominerer i naturen, der repræsenterer naturlige kilder til denne forbindelse. Næsten alle er rigere på kobber end svovl, og deres sammensætning udtrykkes og forenkles med formlen CuxS; her x kan endda tage brøkværdier, der indikerer et ikke-støkiometrisk fast stof (Cu1,75S, for eksempel).

Selvom svovl er gul i sin grundlæggende tilstand, ser dets afledte forbindelser mørke i farve; dette er også tilfældet med kobbersulfid. Imidlertid udviser mineral covelit (topbillede), der primært består af CuS, metallisk glans og blålig iridescens..
De kan fremstilles fra forskellige kilder til kobber og svovl under anvendelse af forskellige teknikker og varierende synteseparametre. Således kan du få CuS nanopartikler med interessante morfologier.
Artikelindeks
- 1 Struktur af kobbersulfid
- 1.1 Links
- 1.2 Koordinationer i covelita
- 1.3 Andre krystaller
- 2 egenskaber
- 2.1 Generelt
- 2.2 Covelite
- 3 anvendelser
- 3.1 Nanopartikler i medicin
- 3.2 Nanovidenskab
- 4 Referencer
Struktur af kobbersulfid
Links
Denne forbindelse ser ud til at være krystallinsk, så det kan straks tænkes, at den er sammensat af Cu-ioner+ (monovalent kobber), Cuto+ (divalent kobber), Sto- og inklusive Sto- og Stoto- (disulfidanioner), som interagerer gennem elektrostatiske kræfter eller ionbinding.
Der er dog en let kovalent karakter mellem Cu og S, og derfor kan Cu-S-bindingen ikke udelukkes. Fra denne ræsonnement begynder den krystallinske struktur af CuS (og den for alle dens afledte faste stoffer) at adskille sig fra dem, der findes eller er karakteriseret for andre ioniske eller kovalente forbindelser..
Med andre ord kan vi ikke tale om rene ioner, men midt i deres attraktioner (kation-anion) er der en lille overlapning af deres eksterne orbitaler (elektrondeling).
Koordinationer i la covelita
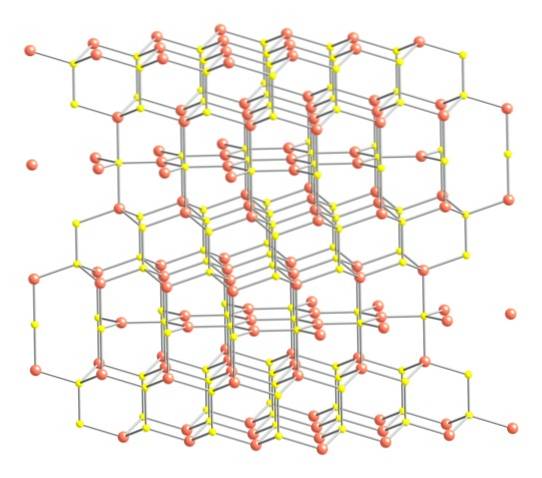
Når det er sagt ovenfor, vises covelitens krystalstruktur i det øverste billede. Den består af sekskantede krystaller (defineret af parametrene for deres enhedsceller), hvor ionerne forenes og orienterer sig i forskellige koordinationer; disse er med et varieret antal nære naboer.
På billedet er kobberioner repræsenteret af lyserøde kugler, mens svovlioner er repræsenteret af gule kugler..
Når man først fokuserer opmærksomheden på de lyserøde sfærer, bemærkes det, at nogle er omgivet af tre gule sfærer (trigonal plan-koordination) og andre af fire (tetrahedral koordination)..
Den første type kobber, trigonal, kan identificeres i flyene vinkelret på de sekskantede ansigter, der vender mod læseren, i hvilke igen den anden type kulstof, tetraeder.
Når vi nu vender os til de gule sfærer, har nogle fem lyserøde sfærer som naboer (trigonal bipyramid-koordination), og andre tre og en gul sfære (igen tetrahedral koordination); I sidstnævnte ses disulfidanionen, som kan ses nedenfor og inden for den samme struktur af covelitten:
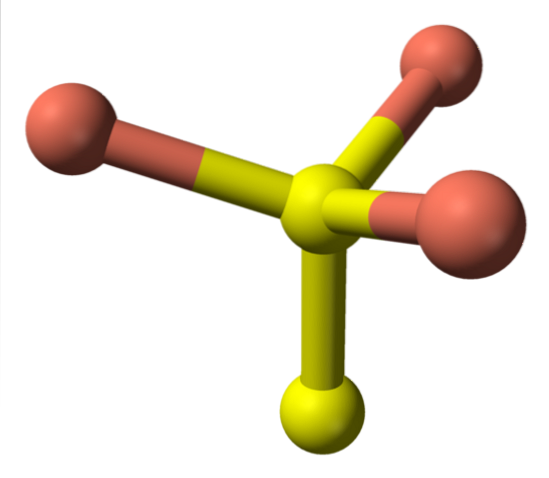
Alternativ formel
Der er så Cu-ionerto+, Cu+, Sto- og Stoto-. Undersøgelser udført med røntgenfotoelektronspektroskopi (XPS) indikerer imidlertid, at alt kobber er som Cu-kationer+; og derfor udtrykkes den oprindelige formel CuS "bedre" som (Cu+)3(S2−) (Sto)-.
Bemærk, at Cu: S-forholdet for ovenstående formel fortsætter med at være 1, og endvidere annulleres afgifterne.
Andre krystaller
Et kobbersulfid kan optage orthorhombiske krystaller, som i polymorfen, y-CutoS, fra chalcocite; kubisk, som i en anden polymorf af chalcocite, α-CutoS; tetragonal, i mineralet anilit, Cu1,75S; monoklinikker, i djurleita, Cu1,96Ja blandt andre.
For hver defineret krystal er der et mineral, og til gengæld har hvert mineral sine egne egenskaber og egenskaber.
Ejendomme
Generel
Egenskaberne af kobbersulfid er underlagt Cu: S-forholdet mellem dets faste stoffer. For eksempel dem med S-anionertoto- har sekskantede strukturer og kan enten være halvledere eller metalliske ledere.
Hvis svovlindholdet derimod kun består af anioner Sto-, sulfider opfører sig som halvledere og udviser også ioniske ledningsevner ved høje temperaturer. Dette skyldes, at dets ioner begynder at vibrere og bevæge sig inden i krystallerne og dermed transportere elektriske ladninger..
Optisk, selvom det også afhænger af deres kobber- og svovlsammensætning, kan sulfider muligvis absorbere stråling i det infrarøde område af det elektromagnetiske spektrum. Disse optiske og elektriske egenskaber gør det til potentielle materialer at blive implementeret i forskellige enheder af enheder..
En anden variabel, der skal overvejes, ud over Cu: S-forholdet, er størrelsen på krystallerne. Det er ikke kun, at der er mere "svovl" eller "kobber" kobbersulfider, men dimensionerne af deres krystaller giver en upræcis effekt på deres egenskaber; Således er forskere ivrige efter at undersøge og søge applikationer til Cu-nanopartikler.xSY.
Covelite
Hvert mineral eller kobbersulfid har unikke egenskaber. Imidlertid er covelite af dem alle de mest interessante fra et strukturelt og æstetisk synspunkt (på grund af sin iridescens og blå toner). Derfor er nogle af dens egenskaber nævnt nedenfor.
Molar masse
95,611 g / mol.
Massefylde
4,76 g / ml.
Smeltepunkt
500 ° C; men det går i stykker.
Vandopløselighed
3.3 10-5 g / 100 ml ved 18 ° C.
Ansøgninger
Nanopartikler i medicin
Ikke kun varierer partiklernes størrelse, indtil de når nanometriske dimensioner, men deres morfologier kan også variere meget. Kobbersulfid kan således danne nanosfærer, stænger, plader, tynde film, bure, kabler eller rør..
Disse partikler og deres attraktive morfologier erhverver individuelle anvendelser inden for forskellige medicinske områder..
For eksempel kan nanocages eller tomme kugler tjene som lægemiddelbærere i kroppen. Nanosfærer er blevet anvendt understøttet af kulstofglaselektroder og kulstofnanorør til at fungere som glukosedetektorer; såvel som dets aggregater er følsomme over for påvisning af biomolekyler, såsom DNA.
CuS-nanorør overgår nanosfærer ved detektion af glukose. Ud over disse biomolekyler er immunsensorer designet fra tynde CuS-film og visse understøtninger til påvisning af patogener..
Nanokrystaller og amorfe aggregater af CuS kan endda forårsage apoptose af kræftceller uden at forårsage skade på sunde celler.
Nanovidenskab
I det foregående underafsnit blev det sagt, at dets nanopartikler har været en del af biosensorer og elektroder. Ud over sådanne anvendelser har forskere og teknikere også udnyttet dets egenskaber til at designe solceller, kondensatorer, lithiumbatterier og katalysatorer til meget specifikke organiske reaktioner; Uundværlige elementer inden for nanovidenskab.
Det er også værd at nævne, at NpCuS-CA-sættet (CA: Aktivt kul og Np: Nanopartikler) viste sig at fungere som en fjerner af farvestoffer, der er skadelige for mennesker og når det understøttes af aktivt kul, og fungerer derfor som en renser af kilder til vandabsorberende uønskede molekyler.
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Wikipedia. (2019). Kobbersulfid. Gendannet fra: en.wikipedia.org
- Ivan Grozdanov og Metodija Najdoski. (nitten femoghalvfems). Optiske og elektriske egenskaber af kobbersulfidfilm med variabel sammensætning. Journal of Solid State Chemistry bind 114, udgave 2, 1. februar 1995, sider 469-475. doi.org/10.1006/jssc.1995.1070
- National Center for Biotechnology Information. (2019). Kobbersulfid (CuS). PubChem-database. CID = 14831. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Peter A. Ajibade og Nandipha L. Botha. (2017). Syntese, optiske og strukturelle egenskaber
- af kobbersulfid-nanokrystaller fra enkeltmolekylforløbere. Institut for Kemi, University of Fort Hare, Privat taske X1314, Alice 5700, Sydafrika. Nanomaterialer, 7, 32.
- Samarbejde: Forfattere og redaktører af bindene III / 17E-17F-41C (s.f.). Kobbersulfider (Cu2S, Cu (2-x) S) krystalstruktur, gitterparametre. I: Madelung O., Rössler U., Schulz M. (red.) Ikke-tetraedrisk bundne elementer og binære forbindelser I. Landolt-Börnstein-gruppe III kondenseret stof (numeriske data og funktionelle forhold inden for videnskab og teknologi), bind 41C. Springer, Berlin, Heidelberg.
- Momtazan, F., Vafaei, A., Ghaedi, M. et al. Korean J. Chem. Eng. (2018). Anvendelse af kobbersulfidnanopartikler fyldt aktivt kul til samtidig adsorption af ternære farvestoffer: Metode til reaktionsoverflade. 35: 1108. doi.org/10.1007/s11814-018-0012-1
- Goel, S., Chen, F., & Cai, W. (2014). Syntese og biomedicinske anvendelser af kobbersulfid nanopartikler: fra sensorer til theranostics. Lille (Weinheim an der Bergstrasse, Tyskland), 10 (4), 631-645. doi: 10.1002 / smll.201301174



Endnu ingen kommentarer