
Wrights begrundelse, materialer, teknik og anvendelser

Det Wright plet er en farvningsteknik skabt af den amerikanske patolog James Homer Wright i 1902, baseret på Romanowsky-pletten. Da Romanowsky-pletten var ustabil, inkorporerede Wright methanol som opløsningsmiddel og fikseringsmiddel..
Denne farve er polykromatisk, hvilket betyder, at den genererer flere farver afhængigt af strukturen, der absorberer farvestoffet. Denne farvningsteknik er blevet udbredt til at udføre differentierede antal hvide blodlegemer og til at studere morfologien af røde blodlegemer, blodplader og leukocytter i perifert blod og knoglemarv..
Dens anvendelse er meget vigtig, da abnormiteter kan ses i de forskellige cellelinjer i blodet, hvilket letter diagnosen af sygdomme som leukæmi eller bakterielle eller parasitære infektioner..
Måske er dette de mest almindelige applikationer, hvor denne teknik anvendes, men de er ikke de eneste. Det er også nyttigt i andre prøver end blod og knoglemarv, såsom nasal udflåd, fækalt slim, sputum, hudprøver, blandt andre..
Artikelindeks
- 1 Begrundelse for Wrights plet
- 2 Materialer
- 2.1 Forberedelse
- 2.2 Bufferopløsning
- 2.3 Yderligere materialer, der er nødvendige for at udføre farvningen
- 3 Komponenter af Wrights plet
- 3.1 Methanol
- 3.2 Spjældet
- 3.3 Eosin (Y)
- 3.4 Methylenblåt
- 4 teknik
- 5 Hjælpeprogram
- 5.1 Hæmatologi
- 5.2 Næseudflåd
- 5.3 Parasitologi
- 5.4 Luftvejsinfektioner
- 5.5 Bakteriologi
- 5.6 Mykologi
- 6 Hvordan observeres blodprøvestrukturerne med Wright-pletten?
- 7 Anbefalinger til god farvning
- 8 Almindelige fejl i Wright-farvning
- 8.1 Meget bleg farvning
- 8.2 Farvestof udfældes
- 8.3 Udtværing med ekstremt rødlig eller blå farve
- 9 Opbevaringstilstand
- 10 Referencer
Begrundelse for Wrights plet
Wright-pletten blev født af Romanowsky-pletten, som består af en methylalkoholopløsning af et surt farvestof (eosin Y) og et basisk farvestof (methylenblåt) og deres oxidationsprodukter..
Blandingen af farvestoffer, der anvendes i Wrights plet, forårsager den virkning, der er kendt som Romanowsky, det vil sige, det giver en smuk lilla farve til kernerne af leukocytter og neutrofile granuler, mens de røde blodlegemer pletter lyserøde..
Komponenterne, der er ansvarlige for at give den typiske farveskala for Wrights plet, er blå B og eosin Y. Den observerede effekt vil afhænge af farvestoffernes binding til kemiske strukturer og vekselvirkningerne mellem blå B og eosin Y.
Surstrukturer såsom nukleinsyrer, nukleare proteiner og den reaktive umodne cytoplasma af nogle celletyper, fikserer blå B (grundlæggende plet).
Mens basiske strukturer såsom hæmoglobin, binder granulaterne af segmenterede eosinofiler, blandt andre cellulære strukturer, eosin Y (surt farvestof).
Farvningsresultatet kan påvirkes af forskellige faktorer, såsom pH-værdien af Wright-farvestoffet, bufferen og vaskeopløsningen; samt farvning og fikseringstid.
Derfor er hvert trin i klargøring af reagenser afgørende og skal udføres under hensyntagen til alle detaljer..
Materialer
Wrights plet. For 100 ml kræves det:
Afvej 0,3 g Wrights plet, mål 97 ml methanol og 3 ml glycerol.
Forberedelse
I en mørtel placeres den tunge mængde Wrights plet og inkorporerer gradvis glycerolen, indtil pulveret er helt opløst..
Derefter tilsættes methanolen, blandes og hældes i en ravfarvet flaske.
Før brug skal opløsningen rystes med blide bevægelser og filtreres.
Buffer bufferopløsning
I en liter destilleret vand tilsættes 3,76 g dinatriumhydrofosfat (NatoHPO4 2Hto0) plus 2,1 g dihydrogenkaliumphosphat (KHtoPO4).
Bland meget godt, indtil alle de inkorporerede reagenser er opløst. Juster pH til 7,2. Hæld i en glasbeholder og opbevar ved stuetemperatur.
Yderligere materialer, der er nødvendige for at udføre farvningen
Derudover kræves andre materialer for at være i stand til at udføre farvningsteknikken, disse er: objektglas eller dækker genstande, farvelægningsbro, t-shirts med vand eller buffer til vask, et stopur til at holde farvetiderne og noget blottingmateriale. (absorberende papir, gaze eller bomuld).
Komponenter af Wrights plet
Methanol
Alkohol (methanol) fungerer som et fiksativ af blodudstrygningen til objektglasset.
Det er dybest set et reducerende, dehydratiserende og koagulerende fiksativ reagens. Derfor er dens funktion at koagulere proteiner og gøre dem uopløselige, men uden faktisk at denaturere dem..
Methanol er det mest anvendte smear fixeringsreagens i alle laboratorier, da det giver bedre resultater end ethanol. Den ideelle koncentration er 99%.
Spjæld
Pufferen (bufret opløsning) har funktionen til at justere eller opretholde farvestoffets pH, da en pH justeret til 7,2 er afgørende for, at cellestrukturer er i stand til at absorbere farvestofferne korrekt..
På den anden side dehydrerer methanolfikseringstrinnet cellerne, og bufferen hjælper med at rehydrere dem..
Eosin (Y)
Eosin har en affinitet for byggesten, fordi det er et surt farvestof. To typer eosin kendes meget lig hinanden, så meget at en af de to kan bruges, hvilket opnår det samme resultat..
Den ene kaldes eosin Y, gul eosin eller tetrabromofluorescein, og den anden kaldes eosin B, blålig erythrosin B eller dibromodinitrofluorescein. Imidlertid er eosin Y den mest anvendte.
Den vigtigste egenskab ved dette farvestof er dets negative polaritet, hvilket gør det tiltrukket af positivt ladede cellestrukturer.
Methylenblåt
Det er den grundlæggende farve. Dens vigtigste egenskab er metakromasi, det vil sige, ikke alle strukturer farves i samme farve, det afhænger af den kemiske sammensætning af de strukturer, der bliver farvet..
Nogle bliver lys eller mørkeblå, og andre bliver mørke lilla eller blege lilla.
Teknik
1-Udfør spredning af prøven, så der forbliver en tynd film, enten på et dias eller dækglas.
2-Lad det tørre i luften i cirka 2 timer.
3-Placer den tørre udstrygning på farvningsbroen eller farvningsbakken med spredningen af prøven opad..
4-Dæk arket med Wright-pletten dråbe for dråbe, indtil hele overfladen er dækket. Lad det virke i 5-8 minutter.
5-Pletten skal helt dække objektglasset uden at spildes over kanterne. Hvis det i løbet af farvetiden begynder at fordampe, skal du tilføje et par ekstra dråber.
6-Tilsæt derefter en lige stor mængde støddæmper, blæs lidt, indtil den karakteristiske metalliske glans vises. Timing 10 til 15 minutter.
7-Vask med ledningsvand, placer den blide strøm, indtil lagen ser lyserød ud.
8-Med en gasbind imprægneret med alkohol fjernes farvestoffet, der er klæbet på bagsiden af objektglasset.
9-Lad udtværingen tørre meget godt, inden du placerer nedsænkningsolien for at se den under mikroskopet.
Hjælpeprogram
Hæmatologi
Det er ideelt til farvning af perifert blodudstrygning, til undersøgelse af tykke blodudstrygninger og til undersøgelse af celler fra knoglemarvsprøver.
På grund af de kemiske egenskaber ved denne kombination af farvestoffer kan cellestrukturer let genkendes, idet de kan skelne mellem de forskellige tilstedeværende celler.
Løbende næse
Denne teknik er meget nyttig til at identificere cellerne i næseafladningen (epitelceller, segmenterede eosinofiler, polymorfonukleære celler) ved diagnosen allergisk rhinitis..
parasitologi
I denne forstand har det været nyttigt til undersøgelse af Leishmania sp inden for histiocytterne i det subkutane cellulære væv i hudsår. Ligeledes bruges det til at identificere leukocytter i afføringsprøver (fækalt leukogram).
I dette tilfælde er det af interesse for lægen at vide, om leukocytosen, der er til stede i afføringen, er polymorfonuklear eller mononuklear. Dette fund i fækalt leukogram vil lede, om det er henholdsvis en bakteriel eller en virusinfektion..
På den anden side kan parasitter, der cirkulerer i blodet, findes i erytrocyten eller fri i plasmaet. De søgte parasitter er Plasmodium spp, Trypanosoma cruzii og filariae, og inden for veterinærmedicin er det nyttigt i søgningen efter Theileria equi Y Babesia caballi, forårsagende agenser for bebesiose, især i heste.
Wright-pletten og også Giemsa-pletten gør det muligt at differentiere hæmoparasitter fra normale cellulære komponenter. To typer opslag kan bruges til dette:
Spredes fint
Blod spredes som en tynd film på et dias. Farvet med Wrights plet og afslører kerne- og cytoplasmaegenskaberne.
Tykt fald
Denne metode bruges til at undersøge tilstedeværelsen af parasitter i en større mængde blod..
For at gøre dette placeres en stor dråbe blod på et dias. En gang der skal den defibrilleres, idet der bliver større og større cirkler fra midten og udefter ved hjælp af kanten af et andet objektglas..
Endelig skal erythrocytterne lyseres med vand for at være i stand til at observere parasitterne i den tykke udstrygning..
Luftvejsinfektioner
På det respiratoriske niveau er denne teknik også nyttig, fordi cellerne, der er til stede i prøverne af sputum, bronchial lavage eller bronchoalveolar, er vigtige for at fastslå diagnosen..
Tilsvarende kan der skelnes mellem polymorfonukleære celler og mononukleære celler her..
Bakteriologi
Anvendelsen af denne teknik i bakteriologi er begrænset, fordi den ikke er god til farvning af bakterier, hvorfor andre specialiserede farvningsteknikker anvendes til farvning af dem..
Det er imidlertid blevet brugt til at søge efter epitelceller med inklusionslegemer af Chlamydia trachomatis i udstrygninger af urinrøret eller endocervikal slimhinde, selvom det skal erkendes, at det ikke er den bedste metode til dette.
Det er også muligt at observere spiralignende bakterier såsom Borrelia burgdorferi hos inficerede patienter såvel som morulae eller inklusionslegemer af Ehrlichia sp i cytoplasmaet af lymfocytter, monocytter eller neutrofiler i en blodudstrygning.
Mykologi
Det Histoplasma capsulatum er en patogen svamp, der ofte diagnosticeres ved mikroskopisk observation af forskellige vævsprøver, farvet med Wrights plet.
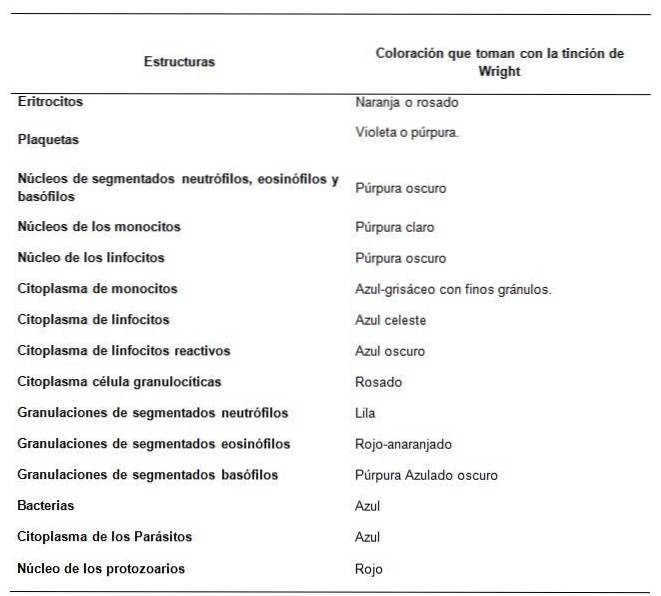
Hvordan observeres blodprøvestrukturerne med Wright-pletten?
Anbefalinger til god farvning
Udtværing af blodprøver skal lufttørre spontant. Udstrygninger skal være så tynde som muligt for at opnå bedre fiksering af farvestoffet og undgå overfarvning..
Ved farvning af høj kvalitet tilrådes det at plette inden for to timer efter klargøring af udstrygningen. På den anden side er den ideelle prøve kapillærblod uden antikoagulant.
Hvis der anvendes venøst blod, skal det dog bruges som et antikoagulant EDTA og ikke heparin, da sidstnævnte kan deformere cellestrukturer.
For at undgå forringelse af det forberedte farvestof skal det opbevares på tørre steder.
Under vaskeprocessen anbefales brug af vand justeret til en neutral pH..
Endelig anbefales det at afprøve de farvningsmetoder, der anvendes i laboratoriet med jævne mellemrum..
Dette gøres ved farvning af prøver eller udvidede mønstre som en kvalitetskontrol. Dette trin er vigtigt, da det sikrer, at farvningen er korrekt forberedt, og farvningstiderne er standardiserede..
Hvis mønsterarket er dårligt farvet, er der problemer, der skal løses..
Almindelige fejl i Wright-farvning
Meget bleg farvning
Meget blege udstrygninger skyldes normalt en meget kort farvningstid eller overdreven vask. Det korrigeres ved at forlænge kontakttiden med farvestoffet eller nedsætte vasketiden.
Farvestof udfældes
Tilstedeværelsen af farvestofudfældninger i udstrygningen kan have flere årsager, men de hyppigste årsager er: brug af ufiltreret farvestof, farvning på ujævn farvningsbroer, brug af plader, der er beskidte med støv eller fedt, ikke vask godt færdig farvning.
Ekstremt rød eller blå udstrygning
Pufferen er ansvarlig for farvestoffets pH. Farvestoffer med en pH-værdi under den angivne (sure) vil resultere i meget rødlige udstrygninger..
Hvis farvestoffets pH er over (alkalisk) opnås en ekstremt blålig udstrygning.
Opbevaringstilstand
Reagenset skal opbevares ved stuetemperatur.
Referencer
- Gutiérrez V. Sammenligningsundersøgelse mellem Wright-farvningsmetoden og Elisa-testen til diagnose af hundehrlichiose i byen San Pedro Sula, Honduras. 2008. Kandidatafhandling for at kvalificere sig til titlen som veterinærlæge. University of San Carlos i Guatemala.
- López-Jácome L, Hernández-Durán M, Colín-Castro C, Ortega-Peña S, Cerón-González G, Franco-Cendejas F. Grundlæggende pletter i mikrobiologilaboratoriet. Forskning i handicap. 2014; 3 (1): 10-18.
- "Wrights plet." Wikipedia, The Free Encyclopedia. 18. maj 2018, 12:05 UTC. 8. dec 2018, 20:37
- Calderón A, Cardona J, Vergara Ó. Hyppighed af Babesia spp. på montería-heste, Córdoba (Colombia). Præst udcaaktuel afsløring. 2013; 16 (2): 451-458.
- Forbes B, Sahm D, Weissfeld A (2009). Bailey & Scott mikrobiologisk diagnose. 12. udgave Argentina. Redaktionel Panamericana S.A.
- Retamales E, Mazo V. Institute of Public Health Government of Chile. Anbefalinger til farvning af blodudstrygninger til aflæsning af blodtal.



Endnu ingen kommentarer