
Natriumthiosulfat (Na2S2O3) formel, egenskaber og anvendelser
Det natriumthiosulfat eller natriumhyposulfit (NatoStoELLER3) Det er et vigtigt uorganisk salt med forskellige medicinske anvendelser. Det er også tilgængeligt som dets pentahydrerede salt (NatoStoELLER3.5HtoELLER).
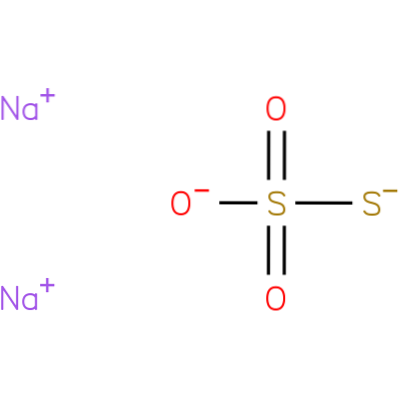
Det er en ionisk forbindelse dannet af to natriumkationer (Na+) og den negativt ladede thiosulfatanion (StoELLER3-), hvor det centrale svovlatom er bundet til tre iltatomer og et andet svovlatom (dermed præfikset onkel) gennem enkelt- og dobbeltbindinger med resonanskarakter. Det faste stof findes i en monoklinisk krystalstruktur.
Natriumthiosulfat kan fremstilles ved opvarmning af svovl med en vandig opløsning af natriumsulfit eller en vandig opløsning af natriumhydroxid..
6NaOH + 4S → NatoStoELLER3 + 2NatoS + 3HtoELLER
Det er et lægemiddel, der er på listen over essentielle lægemidler fra Verdenssundhedsorganisationen, de mest effektive og sikre lægemidler, der er nødvendige i et sundhedssystem (Sodium Thiosulfate Formula, S.F.).
Artikelindeks
- 1 Fysiske og kemiske egenskaber
- 2 Reaktivitet og farer
- 3 anvendelser
- 3.1 Medicin
- 3.2 Jodometri
- 3.3 Afklorering af vand
- 3.4 Guldminedrift
- 4 Referencer
Fysiske og kemiske egenskaber
Natriumthiosulfat har en molekylvægt på 158,11 g / mol for sin vandfri form og 248,18 g / mol for pentahydratformen. Derudover har den en densitet på 1.667 g / ml (National Center for Biotechnology Information., 2017).
Natriumthiosulfat er farveløse monokliniske krystaller uden en karakteristisk aroma. Nævnte faste stof er lysende, hvilket betyder, at det i sig selv kan reduceres til støv ved tab af krystallisationsvand, når det udsættes for luft. Dens udseende er vist i figur 2.

Forbindelsen har et smeltepunkt på 48 ° C for pentahydratformen, og fra 100 ° C begynder den at nedbrydes. NatoStoELLER3 Det er meget opløseligt i vand og er i stand til at opløse 70 gram pr. 100 ml opløsningsmiddel. Forbindelsen er praktisk talt uopløselig i ethanol (Royal Society of Chemistry, 2015).
Natriumthiosulfat er et neutralt salt, der let dissocieres i vand for at give natrium- og thiosulfationer. NatoStoELLER3 Det er et stabilt fast stof under normale forhold, men nedbrydes ved opvarmning for at give natriumsulfat og natriumpolysulfid:
4NatoStoELLER3 → 3NatoSW4 + NatoS5
Det nedbrydes også, når det behandles med fortyndede syrer for at give svovl og svovldioxid (kaldet urreaktionen):
NatoStoELLER3 + 2HCl → 2NaCl + S + SOto + HtoELLER
Reagerer støkiometrisk (i ækvimolære mængder) med vandige iodopløsninger, hvilket gør det meget udbredt i laboratorier til jodbaserede titreringer.
Reaktivitet og farer

Natriumthiosulfat er ikke et giftigt materiale og bruges til medicinske formål. Men når det nedbrydes, producerer det giftige svovloxidgasser, som kan forårsage irritation i øjne, hud og slimhinder..
Forbindelsen kan irritere øjnene, huden og luftvejene. Stoffet er giftigt for lunger og slimhinder. Gentagen eller langvarig eksponering for stoffet kan forårsage skader på disse organer..
Hvis forbindelsen kommer i kontakt med øjnene, skal kontaktlinser kontrolleres og fjernes. Øjne skal skylles straks med rigeligt vand i mindst 15 minutter med koldt vand.
I tilfælde af hudkontakt skal det berørte område straks skylles med rigeligt vand i mindst 15 minutter, mens forurenet tøj og sko fjernes. Dæk irriteret hud med et blødgørende middel. Vask tøj og sko inden genbrug. Hvis kontakten er svær, skal du vaske med en desinfektionsmiddel og dække den forurenede hud med en antibakteriel creme.
I tilfælde af indånding skal offeret flyttes til et køligt sted. Hvis man ikke trækker vejret, gives kunstig åndedræt. Giv ilt, hvis vejrtrækningen er vanskelig.
Hvis forbindelsen indtages, bør opkastning ikke induceres, medmindre det er instrueret af medicinsk personale. Løsn stramt tøj såsom en skjortekrave, bælte eller slips.
I alle tilfælde skal øjeblikkelig lægehjælp indhentes. (Sikkerhedsdatablad Sodium thiosulfate vandfri, 2013).
Ansøgninger
Medicin
Natriumthiosulfat kan bruges til at mindske nogle af bivirkningerne ved cisplatin (kræftmedicin). Det bruges til behandling af ekstravasationer under kemoterapi. Natriumthiosulfat forhindrer alkylering og vævsdestruktion ved at tilvejebringe et substrat for alkyleringsmidler, der har invaderet subkutant væv.
Det bruges også med et andet lægemiddel til nødbehandling af cyanidforgiftning (U.S. National Library of Medicine, S.F.).
I denne behandling injiceres natriumnitrit intravenøst for at producere hæmoglobin, der kombineres med cyanidionen og midlertidigt omdanner det til cyanmethoglobinformen. Derefter injiceres natriumthiosulfat.
Thiosulfat tjener som et substrat for enzymet rhodanase, som katalyserer omdannelsen af cyanid til det meget mindre giftige thiocyanat, der udskilles i urinen (HSDB: SODIUM THIOSULFATE, 2003).
Natriumthiosulfat bruges også som en behandling af calcifylaksi hos mennesker i hæmodialyse med nyresygdom i slutstadiet. Der er tilsyneladende et ikke fuldt forstået fænomen, hvorved dette forårsager alvorlig metabolisk acidose hos nogle patienter..
Jodometri
Natriumthiosulfat reagerer støkiometrisk med iod for at give iodid ifølge reaktionen:
2NatoStoELLER3 + I2 → S4ELLER62− + 2I-
Denne egenskab gør, at forbindelsen anvendes som titreringsmiddel til bestemmelse af jod..
Denne særlige anvendelse kan etableres til at måle iltindholdet i vand gennem en lang række reaktioner i Winkler-testen for opløst ilt..
Det bruges også til den volumetriske estimering af koncentrationerne af visse forbindelser i opløsning (f.eks. Hydrogenperoxid) og til estimering af klorindholdet i kommercielt pulveriseret blegemiddel og vand..
Vandafklorering
Natriumthiosulfat bruges til at afklorinere vand, herunder sænkning af klorniveauer til brug i akvarier og svømmebassiner og kurbade og inden for vandbehandlingsanlæg til behandling af etableret tilbagevaskende vand inden frigivelse i floderne.
Reduktionsreaktionen er analog med iodreduktionsreaktionen, thiosulfat reducerer hypochlorit (aktiv ingrediens i blegemiddel) og oxiderer derved til sulfat. Den komplette reaktion er:
4NaClO + NatoStoELLER3 + 2NaOH → 4NaCl + 2NatoSW4 + HtoELLER
Guldminedrift
Natriumthiosulfat er en komponent, der anvendes som et alternativt udvaskningsmiddel til cyanid til guldekstraktion. Imidlertid danner det et stærkt opløseligt kompleks med guld (I) ionerne, [Au (StoELLER3)to]3-.
Fordelen ved denne fremgangsmåde er, at thiosulfat i det væsentlige er ikke-toksisk, og at mineraltyper, der er ildfaste til guldcyanidering, kan udvaskes af thiosulfat (M.G Aylmore, 2001).
Referencer
- EMBL-EBI. (2016, 1. juni). natriumthiosulfat. Gendannet fra ebi.ac.uk: ebi.ac.uk.
- HSDB: NATRIUMTIOSULFAT. (2003, 3. maj). Gendannet fra toxnet: toxnet.nlm.nih.gov.
- G Aylmore, D. M. (2001). Thiosulfat udvaskning af guld-A gennemgang. Minerals Engineering Volume 14, Issue 2, 135-174. sciencedirect.com.
- Sikkerhedsdatablad Natriumthiosulfat vandfrit. (2013, 21. maj). Gendannet fra sciencelab.com.
- National Center for Biotechnology Information… (2017, 18. marts). PubChem Compound Database; CID = 24477. Gendannet fra pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Natriumthiosulfat. Gendannet fra chemspider.com.
- Natriumthiosulfatformel. (S.F.). Gendannet fra softschools: softschools.com.
- S. National Library of Medicine. (S.F.). Natriumthiosulfat (i en vene). Gendannet fra ncbi.nlm.nih.gov.



Endnu ingen kommentarer