
Transmittans hvad er det, diagram over molekylær energi og motion
Det transmission Optisk er kvotienten mellem den nye lysintensitet og den indfaldende lysintensitet på en prøve af gennemskinnelig opløsning, der er blevet belyst med monokromatisk lys..
Den fysiske proces med passage af lys gennem en prøve kaldes lystransmission og transmission det er et mål for lystransmission. Transmittans er en vigtig værdi for at bestemme koncentrationen af en prøve, der generelt opløses i et opløsningsmiddel, såsom vand eller alkohol, blandt andre..
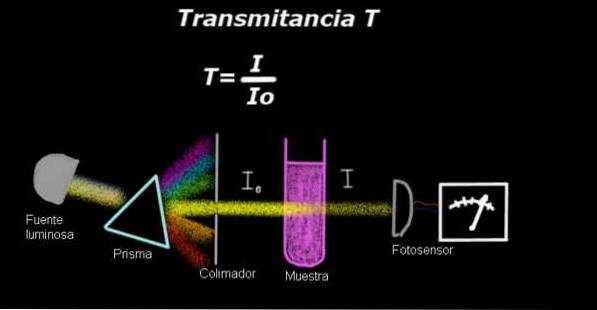
Et elektrofotometer måler en strøm, der er proportional med lysintensiteten, der falder på overfladen. For at beregne transmittans måles intensitetssignalet svarende til opløsningsmidlet normalt først, og dette resultat registreres som Io.
Derefter anbringes den opløste prøve i opløsningsmidlet under de samme lysforhold, og signalet målt med elektro-fotometeret betegnes som jeg, derefter beregnes transmittansen efter følgende formel:
T = I / Ieller
Det skal bemærkes, at transmission er en dimensionsløs størrelse, da det er et mål for lysintensiteten af en prøve i forhold til intensiteten af opløsningsmidlet transmission..
Artikelindeks
- 1 Hvad er transmission??
- 1.1 Absorption af lys i et medium
- 1.2 Molekylær teori om lysabsorption
- 2 Molekylært energidiagram
- 2.1 Faktorer, som transmissionen afhænger af
- 3 Øvelse løst
- 3.1 Øvelse 1
- 4 Referencer
Hvad er transmission??
Lysabsorption i et medium
Når lys passerer gennem en prøve, absorberes noget af lysenergien af molekylerne. Transmittans er det makroskopiske mål for et fænomen, der forekommer på molekylært eller atomniveau.
Lys er en elektromagnetisk bølge, den energi, den bærer, er i bølgens elektriske og magnetiske felt. Disse oscillerende felter interagerer med molekylerne i et stof.
Energien båret af bølgen afhænger af dens frekvens. Monokromatisk lys har en enkelt frekvens, mens hvidt lys har et interval eller spektrum af frekvenser..
Alle frekvenser af en elektromagnetisk bølge bevæger sig i vakuum med den samme hastighed på 300.000 km / s. Hvis vi betegner med c ved lysets hastighed i vakuum, frekvensforholdet F og bølgelængde λ det er:
c = λ⋅f
Hvad c er en konstant ved hver frekvens svarer til dens respektive bølgelængde.
For at måle transmissionen af et stof anvendes regionerne i det synlige elektromagnetiske spektrum (380 nm til 780 nm), det ultraviolette område (180 til 380 nm) og det infrarøde område (780 nm til 5600 nm).
Udbredelseshastigheden for lys i et materialemedium afhænger af frekvensen og er mindre end c. Dette forklarer spredningen i et prisme, hvormed frekvenserne, der udgør hvidt lys, kan adskilles..
Molekylær teori om lysabsorption
Atomer og molekyler har kvantiseret energiniveauer. Ved stuetemperatur har molekylerne de laveste energiniveauer.
Fotonen er kvantepartiklen forbundet med den elektromagnetiske bølge. Fotonens energi kvantiseres også, det vil sige en foton med frekvens F har energi givet af:
E = h⋅f
hvor h er Plancks konstant, hvis værdi er 6,62 × 10 ^ -34 J⋅s.
Monokromatisk lys er en stråle af fotoner med en given frekvens og energi.
Molekyler absorberer fotoner, når deres energi svarer til den forskel, der er nødvendig for at bringe molekylet til et højere energiniveau.
Energiovergange ved absorption af fotoner i molekyler kan være af flere typer:
1- Elektroniske overgange, når elektronerne fra de molekylære orbitaler går til orbitaler med højere energi. Disse overgange forekommer generelt i det synlige og ultraviolette område og er de vigtigste.
2- Vibrationsovergange, de molekylære bindingsenergier kvantificeres også, og når en foton fra det infrarøde område absorberes, går molekylet til en højere vibrationsenergitilstand.
3- Rotationsovergange, når absorptionen af en foton fører molekylet til en rotationstilstand med højere energi.
Molekylært energidiagram
Disse overgange forstås bedst med et molekylært energidiagram vist i figur 2:
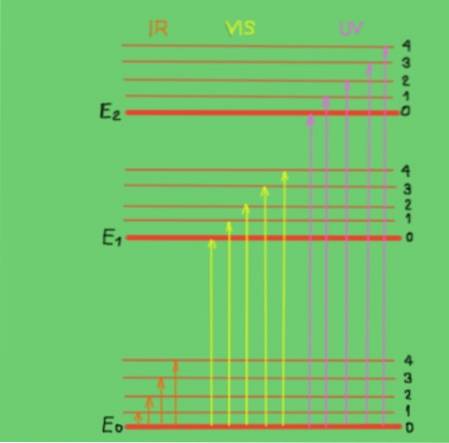
I diagrammet repræsenterer de vandrette linjer forskellige molekylære energiniveauer. E0-linjen er det grundlæggende eller lavere energiniveau. Niveauer E1 og E2 er ophidsede niveauer med højere energi. Niveauerne E0, El, E2 svarer til de elektroniske tilstande i molekylet.
Underniveauerne 1, 2, 3, 4 inden for hvert elektronisk niveau svarer til de forskellige vibrationstilstande svarende til hvert elektroniske niveau. Hvert af disse niveauer har finere underinddelinger, der ikke er vist at svare til de rotationstilstande, der er knyttet til hvert vibrationsniveau..
Diagrammet viser lodrette pile, der repræsenterer energien af fotoner i det infrarøde, synlige og ultraviolette område. Som det kan ses, har infrarøde fotoner ikke nok energi til at fremme elektroniske overgange, mens synlig og ultraviolet stråling gør det..
Når de indfaldende fotoner fra en monokromatisk stråle falder sammen i energi (eller frekvens) med energiforskellen mellem molekylære energitilstande, forekommer absorptionen af fotoner..
Faktorer, som transmissionen afhænger af
Ifølge det, der blev sagt i det foregående afsnit, vil transmissionen derefter afhænge af flere faktorer, blandt hvilke vi kan navngive:
1- Frekvensen, hvormed prøven tændes.
2- Den type molekyler, der skal analyseres.
3- Koncentrationen af opløsningen.
4- Længden af stien, som lysstrålen rejste.
De eksperimentelle data indikerer, at transmissionen T falder eksponentielt med koncentration C og med længden L af den optiske sti:
T = 10-a⋅C⋅L
I ovenstående udtryk til er en konstant, der afhænger af hyppigheden og typen af stof.
Træning løst
Øvelse 1
En standardprøve af et bestemt stof har en koncentration på 150 mikromol pr. Liter (μM). Når dens transmittans måles med lys på 525 nm, opnås en transmittans på 0,4..
En anden prøve af det samme stof, men med ukendt koncentration, har en transmittans på 0,5, målt ved samme frekvens og med samme optiske tykkelse..
Beregn koncentrationen af den anden prøve.
Svar
Transmittansen T forfaldes eksponentielt med koncentrationen C:
T = 10-b⋅L
Hvis logaritmen til den tidligere ligestilling tages, forbliver den:
log T = -b⋅C
Fordeling af medlem efter medlem er den tidligere ligestilling, der er anvendt på hver prøve, og løsning af den ukendte koncentration forbliver:
C2 = C1⋅ (log T2 / log T1)
C2 = 150μM⋅ (log 0,5 / log 0,4) = 150μM⋅ (-0,3010 / -0,3979) = 113,5 μM
Referencer
- Atkins, s. 1999. Fysisk kemi. Omega-udgaver. 460-462.
- Guiden. Transmittans og absorbans. Gendannet fra: quimica.laguia2000.com
- Miljøtoksikologi. Transmission, absorbans og Lamberts lov. Gendannet fra: repositorio.innovacionumh.es
- Fysisk eventyr. Absorbans og transmission. Gendannet fra: rpfisica.blogspot.com
- Spektrofotometri. Gendannet fra: chem.libretexts.org
- Miljøtoksikologi. Transmission, absorbans og Lamberts lov. Gendannet fra: repositorio.innovacionumh.es
- Wikipedia. Transmission. Gendannet fra: wikipedia.com
- Wikipedia. Spektrofotometri. Gendannet fra: wikipedia.com



Endnu ingen kommentarer