
Triethylamin struktur, egenskaber, anvendelser og risici
Det triethylamin er en organisk forbindelse, mere præcist en alifatisk amin, hvis kemiske formel er N (CHtoCH3)3 eller NEt3. Ligesom andre flydende aminer har den en lugt, der ligner ammoniak blandet med fisk; Dampene gør det kedeligt og farligt at håndtere dette stof uden emhætte eller passende tøj.
Ud over deres respektive formler forkortes denne forbindelse ofte som TEA; dette kan imidlertid føre til forveksling med andre aminer, såsom triethanolamin, N (EtOH)3, eller tetraethylammonium, en kvaternær amin, NEt4+.

Fra dets skelet (øverste billede) kan det siges, at triethylamin ligner meget ammoniak; mens det andet har tre hydrogener, NH3, den første har tre ethylgrupper, N (CHtoCH3)3. Dens syntese starter fra behandlingen af flydende ammoniak med ethanol, der forekommer en alkylering.
Nettet3 kan danne et hygroskopisk salt med HCI: triethylaminhydrochlorid, NEt3· HCl. Ud over dette deltager det som en homogen katalysator i syntesen af estere og amider, hvilket gør det til et nødvendigt opløsningsmiddel i organiske laboratorier..
Sammen med andre reagenser tillader det også oxidation af primære og sekundære alkoholer til henholdsvis aldehyder og ketoner. Ligesom ammoniak er en base og kan derfor danne organiske salte gennem neutraliseringsreaktioner.
Artikelindeks
- 1 Struktur af triethylamin
- 2 egenskaber
- 2.1 Fysisk udseende
- 2.2 Molær masse
- 2.3 Kogepunkt
- 2.4 Smeltepunkt
- 2,5 Massefylde
- 2.6 Opløselighed
- 2.7 Dampmassefylde
- 2.8 Damptryk
- 2.9 Henry er konstant
- 2.10 Flammepunkt
- 2.11 Selvantændelsestemperatur
- 2.12 Varmekapacitet
- 2.13 Forbrændingsvarme
- 2.14 Fordampningsvarme
- 2.15 Overfladespænding
- 2.16 Brydningsindeks
- 2.17 Viskositet
- 2.18 Grundlæggende konstant
- 2.19 Grundlæggende
- 3 anvendelser
- 3.1 Polymerer
- 3.2 Kromatografi
- 3.3 Kommercielle produkter
- 4 risici
- 5 Referencer
Struktur af triethylamin
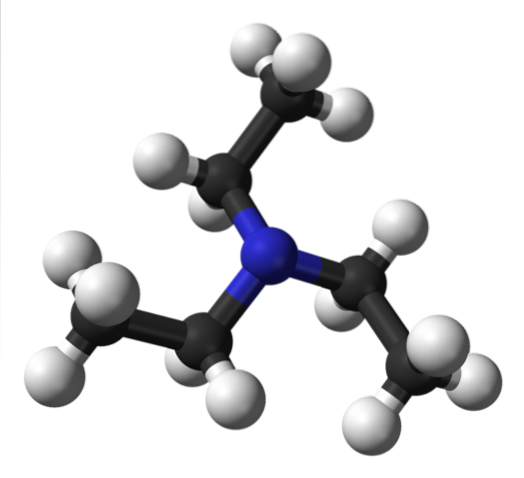
Det øverste billede viser strukturen af triethylamin med en model af kugler og stænger. I midten af molekylet er nitrogenatomet repræsenteret af en blålig kugle; og knyttet til det, de tre ethylgrupper, som små grene af sorte og hvide kugler.
Selvom de ikke er synlige for det blotte øje, er der på nitrogenatomet et par ikke-delte elektroner. Disse to elektroner og de tre-CH gruppertoCH3 de oplever elektroniske frastød men på den anden side bidrager de til at definere dipolmomentet af molekylet.
Imidlertid er et sådant dipolmoment mindre end fx diethylamin, NHEtto; og ligeledes mangler den enhver mulighed for at danne hydrogenbindinger.
Dette skyldes, at der i triethylamin ikke er nogen N-H-binding, og derfor observeres lavere smelte- og kogepunkter sammenlignet med andre aminer, der interagerer på en sådan måde..
Selv om der er et lille dipolmoment, kan dispersionskræfterne mellem ethylgrupperne i NEt-molekyler ikke udelukkes.3 naboer. Hvis man tilføjer denne effekt, er det berettiget, at selvom triethylamin er flygtigt, koger det ved omkring 89 ° C takket være dets relativt store molekylvægt..
Ejendomme
Fysisk fremtoning
Farveløs væske med ubehagelig ammoniak og fiskelugt.
Molar masse
101,193 g / mol.
Kogepunkt
89ºC.
Smeltepunkt
-115 ° C Bemærk, hvor svage de intermolekylære kræfter er, der binder triethylaminmolekylerne i deres faste stof.
Massefylde
0,7255 g / ml.
Opløselighed
Det er relativt opløseligt i vand, 5,5 g / 100 g ved 20 ° C. Under 18,7 ºC er det ifølge Pubchem endda blandbart med dette.
Ud over at "komme sammen" med vand er det også opløseligt i acetone, benzen, ethanol, ether og paraffin..
Dampmassefylde
3,49 i luftforhold.
Damptryk
57,07 mmHg ved 25 ° C.
Henry er konstant
66 μmol / Pa Kg.
antændelsespunkt
-15ºC.
Selvantændelsestemperatur
312ºC.
Varmekapacitet
216,43 kJ / mol.
Forbrændingsvarme
10.248 cal / g.
Fordampningsvarme
34,84 kJ / mol.
Overfladespænding
20,22 N / m ved 25 ° C.
Brydningsindeks
1.400 ved 20 ° C.
Viskositet
0,347 mPa · s ved 25 ° C.
Grundlæggende konstant
Triethylamin har en pKb lig med 3,25.
Grundlæggende
Grundlæggende for denne amin kan udtrykkes ved følgende kemiske ligning:
Net3 + HA <=> NHEt3+ + TIL-
Hvor HA er en svag sur art. NHEt-parret3+TIL- udgør det, der bliver et tertiært ammoniumsalt.
Konjugeret syre NHEt3+ er mere stabil end ammonium, NH4+, fordi de tre ethylgrupper donerer en del af deres elektrondensitet for at nedsætte den positive ladning på nitrogenatomet; derfor er triethylamin mere basisk end ammoniak (men mindre basisk end OH-).
Ansøgninger

Grundlæggende, i dette tilfælde, anvendes nukleofiliciteten af triethylamin til at katalysere syntesen af ester og amider fra et fælles substrat: et acylchlorid, RCOCl (øverste billede).
Her angriber det frie par elektroner fra nitrogen carbonylgruppen og danner et mellemprodukt; som efter hinanden angribes af en alkohol eller en amin for at danne henholdsvis en ester eller amid.
I billedets første række visualiseres mekanismen efterfulgt af reaktionen til fremstilling af esteren, mens den anden række svarer til amidet. Bemærk, at triethylaminhydrochlorid, NEt, produceres i begge reaktioner3HCI, hvorfra katalysatoren udvindes for at starte en ny cyklus.
Polymerer
Nukleofiliciteten af triethylamin bruges også til at føje til visse polymerer, hærde dem og give dem større masser. For eksempel er det en del af syntesen af polycarbonatharpikser, polyurethanskum og epoxyharpikser.
Kromatografi
Dens fjerntliggende amfifilisitet og flygtighed gør det muligt for dets afledte salte at blive brugt som reagenser i ionbytningskromatografi. En anden implicit anvendelse af triethylamin er, at der kan opnås forskellige tertiære aminsalte deraf, såsom triethylaminbicarbonat, NHEt3HCO3 (eller TEAB).
Kommercielle produkter
Det er blevet brugt som tilsætningsstof i formuleringen af cigaretter og tobak, konserveringsmidler til mad, gulvrensere, aromaer, pesticider, farvestoffer osv..
Risici
Triethylamin-dampe er ikke kun ubehagelige, men farlige, da de kan irritere næse, hals og lunger og føre til lungeødem eller bronkitis. Ligeledes, da de er tættere og tungere end luft, forbliver de flugter med jorden og bevæger sig til mulige varmekilder for senere at eksplodere..
Beholdere af denne væske skal være så langt væk fra ilden, fordi de udgør en overhængende fare for eksplosion..
Derudover bør dets kontakt med arter eller reagenser såsom: alkalimetaller, trichloreddikesyre, nitrater, salpetersyre (som det ville danne nitrosoaminer, kræftfremkaldende forbindelser), stærke syrer, peroxider og permanganater undgås..
Det bør ikke berøre aluminium, kobber, zink eller deres legeringer, da det har evnen til at korrodere dem.
Med hensyn til fysisk kontakt kan det forårsage allergier og hududslæt, hvis eksponeringen er akut. Ud over lungerne kan det påvirke leveren og nyrerne. Og med hensyn til øjenkontakt forårsager det irritation, som endda kan skade øjnene, hvis de ikke behandles eller rengøres i tide..
Referencer
- Morrison, R. T. og Boyd, R, N. (1987). Organisk kemi. 5. udgave. Redaktionel Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kemi. (Sjette udgave). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10. udgave.). Wiley plus.
- Wikipedia. (2019). Triethylamin. Gendannet fra: en.wikipedia.org
- Merck. (2019). Triethylamin. Gendannet fra: sigmaaldrich.com
- National Center for Biotechnology Information. (2019). Triethylamin. PubChem-database. CID = 8471. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Toksikologisk datanetværk. (s.f.). Triethylamin. Gendannet fra: toxnet.nlm.nih.gov
- New Jersey Department of Health. (2010). Triethylamin. Gendannet fra: nj.gov



Endnu ingen kommentarer