
Boroxid (B2O3) struktur, egenskaber og anvendelser
Det boroxid eller borsyreanhydrid er en uorganisk forbindelse, hvis kemiske formel er BtoELLER3. Da bor og ilt er elementer i blok p i det periodiske system, og endnu flere hoveder for deres respektive grupper, er forskellen mellem elektronegativitet mellem dem ikke særlig høj; det kan derfor forventes, at BtoELLER3 er kovalent i naturen.
BtoELLER3 Det fremstilles ved opløsning af borax i koncentreret svovlsyre i en smelteovn og ved en temperatur på 750 ° C; termisk dehydrering af borsyre, B (OH)3, ved en temperatur på ca. 300 ° C; eller det kan også dannes som et reaktionsprodukt af diboran (BtoH6) med ilt.

Boroxid kan have et semi-transparent glasagtig eller krystallinsk udseende; sidstnævnte ved formaling kan opnås i pulverform (øverste billede).
Selvom det måske ikke ser ud ved første øjekast, betragtes det som BtoELLER3 som en af de mest komplekse uorganiske oxider; ikke kun fra et strukturelt synspunkt, men også på grund af de variable egenskaber erhvervet af briller og keramik, hvortil dette føjes til deres matrix.
Artikelindeks
- 1 Struktur af boroxid
- 1.1 BO3 enhed
- 1.2 Krystalstruktur
- 1.3 Glasstruktur
- 2 egenskaber
- 2.1 Fysisk udseende
- 2.2 Molekylær masse
- 2.3 Smag
- 2.4 Tæthed
- 2.5 Smeltepunkt
- 2.6 Kogepunkt
- 2.7 Stabilitet
- 3 Nomenklatur
- 4 anvendelser
- 4.1 Syntese af bornrihalogenider
- 4.2 Insekticid
- 4.3 Opløsningsmiddel af metaloxider: dannelse af briller, keramik og borlegeringer
- 4.4 Bindemiddel
- 5 Referencer
Boroxidstruktur
BO-enhed3
BtoELLER3 er et kovalent fast stof, så der er i teorien ingen B-ioner i dets struktur3+ ej heller Oto-, men B-O links. Bor kan ifølge valensbindingsteorien (TEV) kun danne tre kovalente bindinger; i dette tilfælde tre B-O obligationer. Som en konsekvens heraf skal den forventede geometri være trigonal, BO3.
BO-molekylet3 det er elektronmangel, især iltatomer; dog kan flere af dem interagere med hinanden for at levere den nævnte mangel. Således er trekanterne BO3 slutte sig sammen ved at dele en iltbro og fordeles i rummet som netværk af trekantede rækker med deres plan orienteret på forskellige måder.
Krystalstruktur
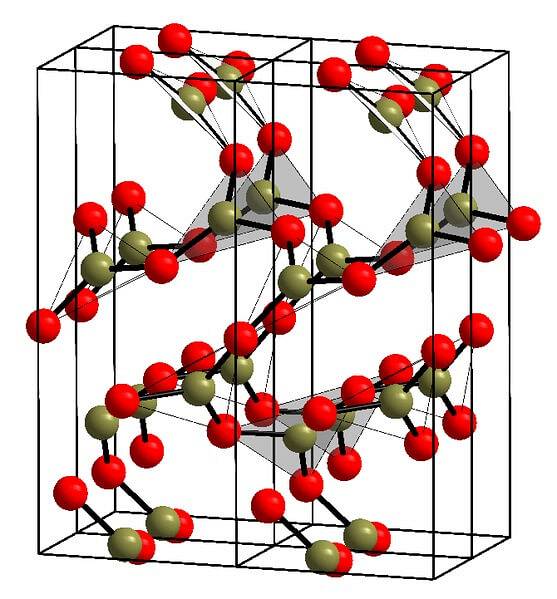
Et eksempel på sådanne rækker med trekantede enheder BO er vist på billedet ovenfor.3. Hvis du ser nøje, peger ikke alle planernes ansigter mod læseren, men den anden vej. Orienteringen af disse ansigter kan være ansvarlig for, hvordan B definerestoELLER3 ved en bestemt temperatur og et bestemt tryk.
Når disse netværk har et langtrækkende strukturelt mønster, er det et krystallinsk fast stof, der kan bygges fra dets enhedscelle. Det er her, det siges, at BtoELLER3 har to krystallinske polymorfe: α og β.
Α-BtoELLER3 den produceres ved omgivende tryk (1 atm) og siges at være kinetisk ustabil; faktisk er dette en af grundene til, at boroxid sandsynligvis er en forbindelse, der er vanskelig at krystallisere.
Den anden polymorfe, β-BtoELLER3, det opnås ved høje tryk i GPa-området; derfor skal dens densitet være større end for a-BtoELLER3.
Glasagtige struktur
BO-netværk3 de har naturligvis tendens til at vedtage amorfe strukturer; Disse mangler et mønster, der beskriver molekylerne eller ionerne i det faste stof. Når du syntetiserer BtoELLER3 dens dominerende form er amorf og ikke krystallinsk; med korrekte ord: det er et fast glas mere end krystallinsk.
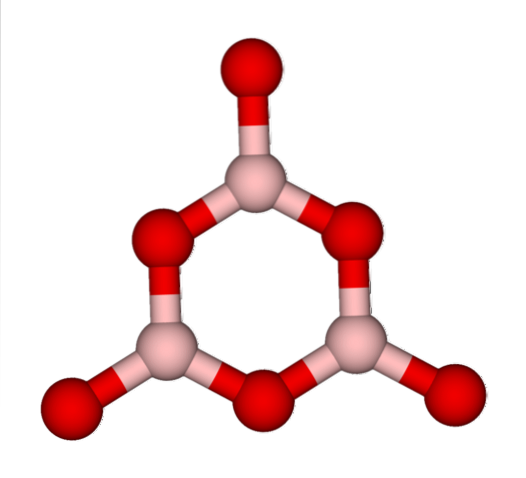
Det siges så, at BtoELLER3 det er glasagtigt eller amorft, når dets BO-netværk3 de er rodet. Ikke kun dette, men de ændrer også måden, de kommer sammen på. I stedet for at være arrangeret i en trigonal geometri, ender de med at forbinde hinanden for at skabe det, forskere kalder en boroxolring (øverste billede).
Bemærk den åbenlyse forskel mellem trekantede og sekskantede enheder. Trekanter karakteriserer BtoELLER3 krystallinsk og sekskantet med BtoELLER3 glaslegemet. En anden måde at henvise til denne amorfe fase er borglas eller med en formel: g-BtoELLER3 ('g' kommer fra ordet glassy på engelsk).
Således g-B-netværktoELLER3 består af boroxolringe og ikke BO-enheder3. Dog g-BtoELLER3 kan krystallisere til α-BtoELLER3, hvilket ville antyde en interkonvertering af ringe til trekanter og også ville definere graden af opnået krystallisation.
Ejendomme
Fysisk fremtoning
Det er et farveløst, glasagtigt fast stof. I sin krystallinske form er den hvid.
Molekylær masse
69,6182 g / mol.
Smag
Lidt bitter
Massefylde
-Krystallinsk: 2,46 g / ml.
-Glasagtigt: 1,80 g / ml.
Smeltepunkt
Det har ikke et fuldt defineret smeltepunkt, fordi det afhænger af, hvor krystallinsk eller glasagtigt det er. Den rent krystallinske form smelter ved 450 ° C; den glasagtige form smelter imidlertid i et temperaturinterval fra 300 til 700 ° C..
Kogepunkt
Igen stemmer de rapporterede værdier ikke overens med denne værdi. Tilsyneladende koger flydende boroxid (smeltet af krystaller eller glas) ved 1860 ° C.
Stabilitet
Det skal holdes tørt, da det absorberer fugt for at omdannes til borsyre, B (OH)3.
Nomenklatur
Boroxid kan navngives på andre måder, såsom:
-Diborontrioxid (systematisk nomenklatur).
-Bor (III) oxid (bestandnomenklatur).
-Boroxid (traditionel nomenklatur).
Ansøgninger
Nogle af anvendelserne til boroxid er:
Syntese af bornrihalogenider
Fra BtoELLER3 kan syntetiseres bortrihalogenider, BX3 (X = F, Cl og Br). Disse forbindelser er Lewis-syrer, og med dem er det muligt at indføre boratomer i visse molekyler for at opnå andre derivater med nye egenskaber..
Insekticid
En fast blanding med borsyre, BtoELLER3-B (OH)3, repræsenterer en formel, der bruges som et husholdningsinsekticid.
Opløsningsmiddel til metaloxider: dannelse af briller, keramik og borlegeringer
Flydende boroxid er i stand til at opløse metaloxider. Fra denne resulterende blanding opnås, når de er afkølet, faste stoffer sammensat af bor og metaller..
Afhængig af mængden af B.toELLER3 anvendt, såvel som teknikken, og typen af metaloxid, et stort udvalg af briller (borosilicater), keramik (bornitrid og carbider) og legeringer (hvis kun metaller anvendes) kan opnås.
Generelt får glas eller keramik større modstand og styrke og også større holdbarhed. I tilfælde af briller bliver de brugt til optiske og teleskoplinser og til elektroniske enheder..
Ringbind
Ved konstruktionen af stålsmelteovne anvendes magnesium-baserede ildfaste mursten. Boroxid bruges som et bindemiddel, hvilket hjælper med at holde dem tæt sammen..
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Wikipedia. (2019). Bor trioxid. Gendannet fra: en.wikipedia.org
- PubChem. (2019). Boroxid. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Rio Tinto. (2019). Borix oxid. 20 Mule Team Borax. Gendannet fra: borax.com
- A. Mukhanov, O. O. Kurakevich og V. L. Solozhenko. (s.f.). På hårdheden af bor (III) oxid. LPMTMCNRS, Université Paris Nord, Villetaneuse, Frankrig.
- Hansen T. (2015). BtoELLER3 (Boroxid). Gendannet fra: digitalfire.com



Endnu ingen kommentarer