
Jernoxidstruktur, egenskaber, nomenklatur, anvendelser
EN jernoxid Det er en hvilken som helst af forbindelserne dannet mellem jern og ilt. De er kendetegnet ved at være ioniske og krystallinske og ligger spredt som et resultat af erosionen af deres mineraler, der sammensætter jorden, plantemassen og endda det indre af levende organismer..
Det er så en af familierne af forbindelser, der dominerer i jordskorpen. Hvad er de nøjagtigt? Der er hidtil kendt 16 jernoxider, hvoraf de fleste af naturlig oprindelse og andre syntetiseres under ekstreme betingelser for tryk eller temperatur..

En del af pulveriseret jernoxid er vist på billedet ovenfor. Dens karakteristiske røde farve dækker jernet fra forskellige arkitektoniske elementer i det, der kaldes rust. Ligeledes observeres det på skråninger, bjerge eller jord blandet med mange andre mineraler, såsom det gule pulver af goethit (α-FeOOH).
De bedst kendte jernoxider er hæmatit (α-FetoELLER3) og maghemit (ϒ- FetoELLER3), begge polymorfe af jernoxid; og ikke mindst magnetit (Fe3ELLER4). Deres polymorfe strukturer og deres store overfladeareal gør dem til interessante materialer som sorbenter eller til syntese af nanopartikler med bred anvendelse..
Artikelindeks
- 1 Struktur
- 1.1 Polymorfisme
- 1.2 Strukturelle links
- 2 egenskaber
- 3 Nomenklatur
- 3.1 Systematisk nomenklatur
- 3.2 Bestandsnomenklatur
- 3.3 Traditionel nomenklatur
- 4 anvendelser
- 4.1 Nanopartikler
- 4.2 Pigmenter
- 5 Referencer
Struktur
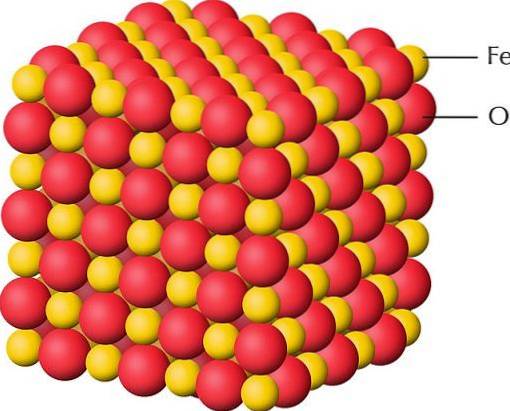
Det øverste billede er en repræsentation af krystalstrukturen af FeO, et af jernoxiderne, hvor jern har en valens på +2. De røde kugler svarer til anionerne Oto-, mens de gule til Fe-kationerneto+. Bemærk også, at hver troto+ er omgivet af seks O'erto-, danner en oktaedrisk koordinationsenhed.
Derfor kan strukturen af FeO "smuldres" til FeO-enheder.6, hvor det centrale atom er Feto+. I tilfælde af oxyhydroxider eller hydroxider er den oktaedriske enhed FeO3(OH)3.
I nogle strukturer, i stedet for oktaeder, er der tetraedriske enheder, FeO4. Af denne grund er jernoxidernes strukturer normalt repræsenteret med octahedra eller tetrahedra med jerncentre..
Strukturen af jernoxider afhænger af forholdene for tryk eller temperatur, af Fe / O-forholdet (dvs. hvor mange oxygener der er pr. Jern og omvendt) og af jernens valens (+2, +3 og, meget sjældent i syntetiske oxider, +4).
Generelt er de store anioner Oto- er justeret og danner ark, hvis huller huser Fe-kationerneto+ o Tro3+. Således er der oxider (såsom magnetit), der har jern med begge valenser.
Polymorfisme
Jernoxider udgør polymorfisme, dvs. forskellige strukturer eller krystalarrangementer for den samme forbindelse. Jernoxid, FetoELLER3, har op til fire mulige polymorfe. Hæmatit, α-FetoELLER3, det er det mest stabile af alle; efterfulgt af maghemitten, Fa- TrotoELLER3, og af det syntetiske β-FetoELLER3 og ε- FetoELLER3.
De har alle deres egne typer krystalstrukturer og -systemer. Imidlertid forbliver forholdet 2: 3 konstant, så der er tre anioner Oto- for hvert andet Fe-kation3+. Forskellen ligger i, hvordan FeO oktaedriske enheder er placeret.6 i rummet, og hvordan kommer I sammen.
Strukturelle links

Octahedral enheder FeO6 kan ses ved hjælp af billedet ovenfor. I hjørnerne af oktaeder er Oto-, mens den er i centrum af troento+ o Tro3+(i tilfælde af FetoELLER3). Den måde, hvorpå disse oktaeder er arrangeret i rummet, afslører strukturen af oxidet.
De påvirker dog også, hvordan de er forbundet. For eksempel kan to octahedra forbindes ved at røre ved to af deres hjørner, som er repræsenteret af en iltbro: Fe-O-Fe. Tilsvarende kan oktaedroner slutte sig gennem deres kanter (støder op til hinanden). Det ville derefter blive repræsenteret med to iltbroer: Fe- (O)to-Tro.
Og endelig kan octahedra interagere gennem deres ansigter. Således ville repræsentationen nu være med tre iltbroer: Fe- (O)3-Fe. Den måde, hvorpå oktaederne er bundet, vil variere de internukleare afstande Fe-Fe og derfor oxidets fysiske egenskaber.
Ejendomme
Et jernoxid er en forbindelse med magnetiske egenskaber. Disse kan være anti-, ferro- eller ferrimagnetiske og afhænger af Fe-valenserne og hvordan kationerne interagerer i det faste stof..
Da strukturen af faste stoffer er meget varieret, er deres fysiske og kemiske egenskaber også.
For eksempel polymorfe og hydrater af FetoELLER3 de har forskellige værdier af smeltepunkter (som ligger mellem 1200 og 1600 ° C) og densiteter. De har imidlertid til fælles den lave opløselighed på grund af Fe3+, den samme molekylvægt, er brun i farve og opløses sparsomt i syreopløsninger.
Nomenklatur
IUPAC etablerer tre måder at navngive et jernoxid på. Alle tre er meget nyttige, skønt for komplekse oxider (såsom Fe7ELLER9) de systematiske regler over de andre ved sin enkelhed.
Systematisk nomenklatur
Antallet af ilt og jern tages i betragtning ved at navngive dem med de græske nummereringspræfikser mono-, di-, tri- osv. Ifølge denne nomenklatur skal FetoELLER3 hedder: trioxid af gavjern. Og for troen7ELLER9 dens navn ville være: ikke-hepta-jernoxid.
Aktienomenklatur
Dette betragter jernets valens. Hvis det handler om troto+, jernoxid er skrevet ..., og dets gyldighed med romertal i parentes. For troentoELLER3 dens navn er: jern (III) oxid.
Bemærk, at Fe3+ kan bestemmes af algebraiske summer. Hvis Oto- Det har to negative ladninger, og der er tre af dem, de tilføjer op til -6. For at neutralisere dette -6 kræves +6, men der er to Fe, så de skal deles med to, + 6/2 = +3:
2X (metalvalens) + 3 (-2) = 0
Simpelthen at løse for X opnås valens af Fe i oxid. Men hvis X ikke er et heltal (som det er tilfældet med næsten alle resterende oxider), så er der en blanding af Feto+ og tro3+.
Traditionel nomenklatur
Suffikset -ico gives til præfikset ferr- når Fe har valens +3, og -oso når dets valens er 2+. FetoELLER3 det hedder: jernoxid.
Ansøgninger
Nanopartikler
Jernoxider har en høj krystallisationsenergi til fælles, hvilket gør det muligt at skabe meget små krystaller, men med et stort overfladeareal..
Af denne grund er de af stor interesse inden for nanoteknologi, hvor de designer og syntetiserer oxidnanopartikler (NP'er) til specifikke formål:
-Som katalysatorer.
-Som et reservoir med lægemidler eller gener i kroppen
-I designet af sensoriske overflader til forskellige typer biomolekyler: proteiner, sukker, fedt
-At gemme magnetiske data
Pigmenter
Fordi nogle oxider er meget stabile, kan de bruges til at farve tekstiler eller give lyse farver til overfladerne på ethvert materiale. Fra mosaikkerne på gulvene; rød, gul og orange (endog grøn) maling; keramik, plast, læder og endda arkitektoniske værker.
Referencer
- Forvaltere af Dartmouth College. (18. marts 2004). Støkiometri af jernoxider. Hentet fra: dartmouth.edu
- Ryosuke Sinmyo et al. (2016, 8. september). Opdagelse af Fe7ELLER9: et nyt jernoxid med en kompleks monoklinisk struktur. Gendannet fra: nature.com
- M. Cornell, U. Schwertmann. Jernoxiderne: struktur, egenskaber, reaktioner, forekomster og anvendelser. [PDF]. WILEY-VCH. Hentet fra: epsc511.wustl.edu
- Alice Bu. (2018). Jernoxid nanopartikler, egenskaber og applikationer. Hentet fra: sigmaaldrich.com
- Ali, A., Zafar, H., Zia, M., ul Haq, I., Phull, A. R., Ali, J. S., & Hussain, A. (2016). Syntese, karakterisering, applikationer og udfordringer af jernoxid-nanopartikler. Nanoteknologi, videnskab og applikationer, 9, 49-67. http://doi.org/10.2147/NSA.S99986
- Golchha Pigmenter. (2009). Jernoxider: Anvendelser. Hentet fra: golchhapigments.com
- Kemisk formulering. (2018). Jern (II) oxid. Hentet fra: formulacionquimica.com
- Wikipedia. (2018). Jern (III) oxid. Hentet fra: https://en.wikipedia.org/wiki/Iron(III)_oxide



Endnu ingen kommentarer