
Acetylcholinesterase struktur, funktioner og hæmmere
Det acetylcholinesterase (acetylcholinacetylhydrolase, EC 3.1.1.7) er et enzym, der hovedsageligt findes i centralnervesystemet. Dens opgave er, som navnet antyder, den hydrolytiske behandling af neurotransmitteren acetylcholin..
Det er et enzym associeret med cellemembranen, der arbejder sammen med acetylcholinreceptoren for at formidle excitationen af postsynaptiske celler, og hvis katalytiske mekanisme er overraskende hurtig.
Fra et mekanisk synspunkt kan dette enzym ses som en serinhydrolase, og i det katalytiske domæne af dets aktive sted indeholder det triaden af aminosyrer, der er karakteristiske for serinproteaser: serin, histidin og en sur rest. Den sure rest er imidlertid et glutamat, mens serinproteaserne normalt har et aspartat..
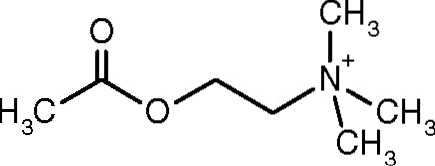
En af de første observationer, der forbandt den katalytiske aktivitet af acetylcholinesterase med kolinerge nervevæv og muskelvæv, blev foretaget af Dale i 1914; senere er det blevet bestemt, at det også er til stede i ikke-kolinerge neuroner og i hæmatopoietiske, osteogene og neoplastiske celler.
Takket være undersøgelsen af forskellige organismer er det i øjeblikket kendt, at enzymet er til stede i membranen i forskellige typer celler, såsom erythrocytter, nerve- og muskelceller, elektriske organer og andre..
Artikelindeks
- 1 Struktur
- 1.1 Tertiær og kvaternær struktur
- 1.2 Primær struktur
- 2 funktioner
- 3 Hæmmere
- 3.1 Irreversible hæmmere
- 3.2 Reversible hæmmere
- 3.3 Butyrylcholinesterase
- 4 Acetylcholinesterase og Alzheimers sygdom
- 5 Referencer
Struktur
Tertiær og kvaternær struktur
Under naturlige forhold eller "in vivo ", acetylcholinesterase er et polymorft enzym, der består af flere katalytiske underenheder på mere eller mindre 80 kDa, der samles til dannelse af en oligomer struktur (af flere underenheder).
Mængden og kompleksiteten af disse underenheder afhænger af celletypen og den art, der overvejes..
Nogle af de mere komplekse enzymformer har katalytiske underenheder med kugleformede (G) eller asymmetriske (A) former forbundet med disulfidbroer. Disulfidbroer er kovalente bindinger dannet mellem to svovlmolekyler i thiolgrupperne (-SH) af to rester af aminosyren cystein.
Hver G-underenhed indeholder et enkelt aktivt sted, mens A-underenhederne generelt er kendetegnet ved at have tre strukturelle domæner, nemlig: katalytiske underenheder, kollagenlignende haler rige på glycin, hydroxyprolin og hydroxylysinrester og andre. Ikke-kollagen lim (bortset fra kollagen).
De asymmetriske former for acetylcholinesterase er kendt som A12, A8 og A4, som har henholdsvis 12, 8 og 4 katalytiske underenheder..
Generelt findes resterne af det katalytiske domæne i det aktive sted i en "dyb" region af underenhederne, hvilket kunne ses som modstridende med hensyn til den hurtige reaktionshastighed, der katalyserer dette enzym, og den tilsyneladende utilgængelighed af substratet til disse websteder..
Uanset polymorfismen af enzymet har både kugleformede og asymmetriske underenheder lignende katalytiske aktiviteter..
Varianter
Nogle andre celler end nerveceller, såsom erythrocytter, producerer overvejende kugleformede, dimere acetylcholinesteraseenzymer, der hovedsagelig er forbundet med plasmamembranens ydre overflade..
Selvom erytrocytenenzymet har mindre strukturel kompleksitet, er det også et amfipatisk enzym, hvis aktive katalytiske domæne findes i det store hydrofile område, mens det hydrofobe domæne, som indeholder det carboxylterminale område, er ansvarlig for at opretholde det i membranen.
Primær struktur
Meget af den nuværende viden om sekvensen af acetylcholinesterase kom frem fra undersøgelsen af enzymet Californica torpedo, en stingray fisk, der lever i Stillehavet og traditionelt er blevet brugt som modelorganisme til undersøgelse af forskellige proteiner i nervesystemet.
Acetylcholinesterase-underenheder syntetiseres som pro-proteiner, der derefter behandles for at give anledning til modne underenheder. Hver underenhed består af et polypeptid på ca. 575 aminosyrer og 65 kDa i molekylvægt, hvilket øges ved tilsætning af 7-8% kulhydratrester (glycosylering)..
Den katalytiske aktivitet af det aktive sted for underenhederne bestemmes af en serinrest i position 200, som findes i et "dybt" område af de katalytiske underenheder..
Forskellige varianter eller isoformer af enzymet findes i organismer takket være forskellige steder for “alternativ splejsning af præ-messenger-RNA'erne i begge ender (5 'og 3'). Den carboxylterminale sekvens af isoformen for hver underenhed er det, der bestemmer samlingen af oligomerer med hinanden..
Funktioner
Acetylcholinesterase er et enzym med flere biologiske funktioner, der ikke nødvendigvis er relateret til hinanden. Fakta attesteret af dens differentielle ekspression under embryogenese, embryonal neurale forlængelse, muskeludvikling og synaptogenese.
Som fremhævet ovenfor har den en vigtig rolle i den hurtige hydrolyse af acetylcholin og derfor i reguleringen af dens virkning i det neuromuskulære synaptiske rum eller i de kolinerge synaptiske rum i centralnervesystemet..
Et eksempel på dets funktioner er sammentrækning af skeletmuskulatur, som opstår takket være en type kemisk synaps kendt som en motorplade, der er placeret mellem en motorneuron og en muskelfiber..
Hundredvis af acetylcholinbelastede vesikler opnås ved denne synaps, som frigøres fra motorneuronen til forplantning af en elektrisk impuls..
Denne neurotransmissionsproces er ret kompleks, dog er deltagelse af acetylcholinesterase afgørende for afslutningen af den synaptiske transmission, der afhænger af neurotransmitteren acetylcholin, da den skal nedbrydes og derefter skal diffundere uden for den synaptiske kløft for at kulminere med membran excitation.
Således er enzymet acetylcholinesterase ansvarlig for at regulere koncentrationen af denne transmitter i den neuromotoriske synaps..
Andre "ikke-klassiske" funktioner i enzymet er relateret til neuritogenese eller vækst af nerveceller; med processerne for celleadhæsion, synaptogenese, aktivering af neuroner-dopamin i substantia nigra i mellemhjerne, hæmatopoietiske processer og poietisk trombe, blandt andre.
Hæmmere
Acetylcholinesterasehæmmere virker ved at forhindre det i at hydrolysere acetylcholin og derved øge niveauet og varigheden af denne neurotransmitter. De kan klassificeres i henhold til deres virkningsmekanisme som reversible og irreversible.
Irreversible hæmmere
Det er dem, der irreversibelt inhiberer den hydrolytiske aktivitet af acetylcholinesterase ved dens kovalente binding til serinresten i enzymets aktive sted. Denne gruppe er hovedsageligt sammensat af organofosfater.
Generelt er disse aktive forbindelser til stede i mange insekticider og er ansvarlige for et stort antal utilsigtede forgiftningsdødsfald. De er estere eller thioler afledt af phosphorsyre, phosphonsyre, phosphinsyre eller phosphoramidinsyre.
Sarin, tabun, soman og cyclosarin er blandt de mest toksiske forbindelser syntetiseret af mennesker, da de kan dræbe et menneske ved at inducere respirations- og kredsløbssvigt ved at blokere acetylcholinesterase i det perifere nervesystem..
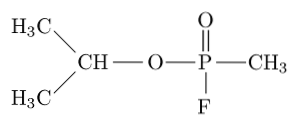
Sarin er for eksempel en "nervegas", der er blevet brugt som et kemisk våben til terrorbrug..
Reversible hæmmere
Denne rækkefølge af klassificering grupperer konkurrerende og ikke-konkurrerende inhibitorer, der virker ved forbigående og reversibel carbamylering af en serinrest i det aktive sted, og mange er blevet syntetiseret og oprenset fra plante- eller svampekilder..
Carbamater, såsom fysostigmin og neostigmin, er reversible hæmmere, der anvendes som lægemidler til henholdsvis sygdomme såsom glaukom og myasthenia gravis..
Andre terapeutiske midler i denne gruppe anvendes også til behandling af Alzheimers sygdom, Parkinsons sygdom, postoperative tarmhindringer (postoperativ ileus), blæreudspænding og som modgift mod antikolinerg overdosis..
Butyrylcholinesterase
En interessant naturlig mekanisme mod nogle acetylcholinesterasehæmmende stoffer har at gøre med deltagelse af et mindre specifikt enzym kendt som butyrylcholinesterase.
Dette enzym er også i stand til at hydrolysere acetylcholin, og på samme tid kan det fungere som et molekylært lokkemiddel, der reagerer med disse toksiner, før de udøver deres negative virkning på acetylcholinesterase..
Acetylcholinesterase og Alzheimers sygdom
Acetylcholinesterase har vist sig at danne et stabilt kompleks med komponenterne i de senile plaques, der er karakteristiske for patologien. Desuden har nogle ændrede glycosyleringsmønstre for dette enzym været relateret til tilstedeværelsen og dannelsen af amyloide plaques i hjernen..
Mange af de reversible acetylcholinesteraseinhibitorer er derfor blevet brugt som førstegenerationsmedicin til behandling af denne sygdom og andre relaterede neurodegenerative tilstande. Disse inkluderer donepezil, rivastigmin og galantamin..
Referencer
- Dvir, H., Silman, I., Harel, M., Rosenberry, T. L., & Sussman, J. L. (2010). Acetylcholinesterase: Fra 3D-struktur til funktion. Kemisk-biologiske interaktioner, 187, 10-22.
- Houghton, P., Ren, Y., og Howes, M. (2006). Acetylcholinesterasehæmmere fra planter og svampe. Naturlige produktrapporter, 2. 3, 181-199.
- Krsti, D. Z., Lazarevi, T. D., Bond, A. M., & Vasi, V. M. (2013). Acetylcholinesterasehæmmere: Farmakologi og toksikologi. Nuværende neurofarmakologi, elleve, 315-335.
- Mukherjee, P. K., Kumar, V., Mal, M., & Houghton, P. J. (2007). Acetylcholinesterasehæmmere fra planter. Phytomedicin, 14, 289-300.
- Quinn, D. M. (1987). Acetylcholinesterase: Enzymstruktur, reaktionsdynamik og virtuelle overgangstilstande. Chem. Rev.., 87, 955-979.
- Racchi, M., Mazzucchelli, M., Porrello, E., Lanni, C., & Govoni, S. (2004). Acetylcholinesterasehæmmere: nye aktiviteter af gamle molekyler. Farmakologisk forskning, halvtreds, 441-451.
- Rosenberry, T. (1975). Acetylcholinesterase. Fremskridt inden for enzymymologi og relaterede områder af molekylærbiologi, 43, 103-218.
- Soreq, H., & Seidman, S. (2001). Acetylcholinesterase - nye roller for en gammel skuespiller. Naturanmeldelser, to, 294-302.
- Talesa, V. N. (2001). Acetylcholinesterase i Alzheimers sygdom. Mekanismer for aldring og udvikling, 122, 1961-1969.



Endnu ingen kommentarer