
XLD agar begrundelse, forberedelse og anvendelser
Det XLD agar eller Xylose Lysine Deoxycholate Agar er et selektivt og differentieret fast dyrkningsmedium til isolering af enteropatogener. Taylor designet XL-agarformlen (Xylose, Lysine) for at forbedre isolationen af slægten Shigella.
Han observerede, at denne slægt blev hæmmet i de fleste medier beregnet til isolering af enteropatogener. Derefter blev natriumdeoxycholat, natriumthiosulfat og jernammoniumcitrat tilsat for at øge dets selektivitet. Denne formel har vist sig at være nyttig til både isolering af Shigella og Salmonella.
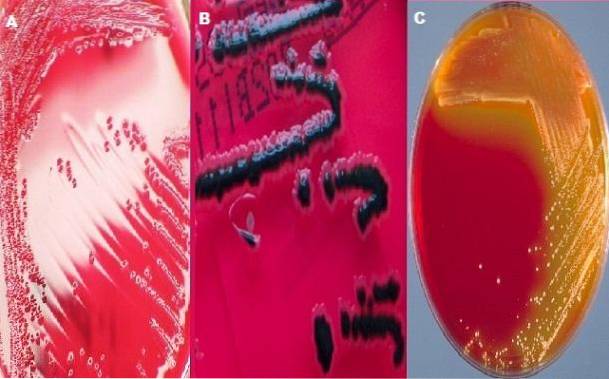
XLD-agar består af gærekstrakt, natriumdeoxycholat, xylose, lysin, lactose, saccharose, natriumthiosulfat, jern-ammoniumcitrat, natriumchlorid, phenolrødt og agar. I de fleste bakteriologilaboratorier anvendes duo XLD-agar og SS-agar til at undersøge fækale prøver for Shigella og Salmonella..
Andre laboratorier foretrækker blandingen CHROMagar Salmonella og XLD-agar blandt andre tilgængelige muligheder. Disse duoer kan tilberedes i dobbelt petriskåle. På den ene side placerer de XLD-agar og på den modsatte side det andet valgte medium.
Artikelindeks
- 1 begrundelse
- 1.1 -Næringsstyrke
- 1.2 -Selektivitet af mediet
- 1.3 -Differentialeffekt
- 1,4-natriumchlorid, agar og phenolrød
- 2 Forberedelse
- 3 anvendelser
- 3.1 Typer af prøver
- 3.2 Sånings- og identifikationsbetingelser
- 4 Kvalitetskontrol
- 5 Afsluttende overvejelser
- 6 Referencer
Basis
-Nærende kraft
XLD agar har gærekstrakt, der tjener som en kilde til næringsstoffer til de mikroorganismer, der udvikler sig på denne agar. Derudover giver tilstedeværelsen af kulhydrater (xylose, saccharose og lactose) energi til bakterierne, der kan fermentere dem.
-Selektivitet af mediet
Som et hæmmende stof har det natriumdeoxycholat; Dette forhindrer væksten af Gram-positive bakterier, hvilket gør mediet selektivt.
-Differentialeffekt
Typiske Shigella-kolonier
Som allerede nævnt indeholder XLD-agar xylose; Dette kulhydrat fermenteres af alle bakterier, der vokser i dette medium undtagen Shigella-slægten..
Dette er en af de egenskaber, der giver den sin differentielle karakter, da Shigella-kolonierne skelnes fra resten ved at udvikle røde kolonier, mens de andre bakterier producerer gule kolonier..
Typiske kolonier af Salmonella
Slægten Salmonella fermenterer også xylose og genererer oprindeligt gule kolonier. Efter nedbrydning af kulhydratxylosen angriber den imidlertid lysin for dets enzym lysindecarboxylase. Decarboxylering af lysin genererer alkalier, der omdanner koloniens farve og det omgivende medium til den oprindelige røde.
Denne adfærd udføres kun af Salmonella, da coliformerne, der decarboxylerer lysin, ikke er i stand til at alkalisere mediet. Dette skyldes, at coliforme stoffer også fermenterer den tilstedeværende lactose og saccharose; produktionen af syrer er derfor meget høj, hvilket efterlader den gule koloni i disse bakterier.
Det skal bemærkes, at slægten Salmonella ikke gærer saccharose eller lactose.
Produktion af HtoS
XLD-agar tillader også påvisning af Salmonella-arter, der producerer HtoS; Til dette har den kilden til svovl repræsenteret af natriumthiosulfat og en reaktionsudvikler, der er jernammoniumcitrat..
Sidstnævnte reagerer med HtoS (farveløs gas) og danner et uopløseligt synligt sort bundfald af jernsulfat. I denne forstand vil salmonellakoloniernes egenskaber være røde med et sort center..
Det skal bemærkes, at til dannelsesreaktionen af HtoJa, en alkalisk pH er nødvendig. Derfor er andre Enterobacteriaceae, der danner HtoS de kan ikke gøre det, eller de gør det dårligt i dette medium, fordi den høje syre, de producerer, når de fermenterer de tilstedeværende kulhydrater, hæmmer eller hindrer reaktionen.
-Natriumchlorid, agar og phenolrødt
Endelig opretholder natriumchlorid den osmotiske balance; agar er størkningsmidlet, og phenolrødt registrerer ændringer i pH, hvilket drejer farven på kolonierne og mediet.
Forberedelse
Afvej 55 g dehydreret XLD-medium og opløses i 1 liter vand. Varm og rør blandingen, indtil den når kogepunktet. Overophed ikke, da varme beskadiger mediet og skaber et bundfald, der ændrer morfologien i typiske kolonier.
Dette medium må ikke autoklaveres. Ved opløsning skal det overføres til et vandbad ved 50 ° C. Ved afkøling skal den serveres direkte på sterile petriskåle. De kan hældes i enkeltplader eller dobbeltplader. De lades størkne og opbevares i køleskabet indtil brug..
Temperer inden brug. Da det er et ikke-sterilt medium, anbefales det at forberede det tæt på datoen for dets anvendelse..
Mediets endelige pH skal være 7,4 ± 0,2. Farven på det fremstillede medium er orange-rød, gennemskinnelig uden bundfald..
Hvis du har Xylose Lysin (XL) base-agar, kan du tilføje natriumdeoxycholat, natriumthiosulfat og jernammoniumcitrat. På denne måde opnås XLD-agarformlen.
Ansøgninger
XLD-agar bruges til genopretning af enteropatogener, hovedsageligt af slægten Shigella og sekundært af slægten Salmonella. Det er nyttigt til evaluering af afføring, vand og madprøver.
Typer af prøver
Afføring
Afføringsprøver kan sås direkte på XLD-agar, hvilket giver en god fordeling af materialet for at opnå isolerede kolonier.
For at forbedre Salmonella-genopretningen kan XLD-agar sås fra Salmonella-berigelsesmedier..
Mad
I tilfælde af mad kan der anvendes berigelsesbuljong til Salmonella og Shigella. Til Salmonella kan du blandt andet bruge selenit cystin bouillon, lysegrøn tetrathionat bouillon..
I tilfælde af Shigella kan den beriges med Shigella-bouillon med 0,5 µ / ml novobiocin, inkuberet ved 42 ° ± 1 ° C i 16-20 timer.
Vand
I vandanalyse anbefales blandt andet membranfiltreringsteknikken og brugen af XLD-agar..
Sånings- og identifikationsbetingelser
Det podede medium inkuberes aerobt ved 35 ° C i 24 til 48 timer..
De typiske kolonier i hver slægt observeres, de mistænkelige kolonier skal gennemgå biokemiske tests for deres identifikation.
QA
Følgende bakteriestammer kan bruges til at evaluere mediumets kvalitetskontrol: Salmonella typhimurium ATCC 14028, Salmonella enteritidis ATCC 13076, Salmonella abony DSM 4224, Shigella flexneri ATCC 12022, Shigella sonnei ATCC 25931, Escherichia coli ATCC 25922, Proteus mirabilis ATCC 43071, Klebsiella pneumoniae ATCC 33495.
Slægten Salmonella er kendetegnet ved at præsentere i dette medium røde kolonier med et sort center eller helt sorte kolonier. Mens der i slægten Shigella skal kolonierne være røde, dvs. mediumets farve.
I tilfælde af Escherichia coli det forventes at blive helt eller delvist hæmmet; hvis den vokser, er kolonierne gule. For at Proteus mirabilis der forventes dårlig vækst med lyserøde kolonier med eller uden et sort center. Til sidst vil slægten Klebsiella vokse som gule kolonier.
Afsluttende tanker
XLD-agar bruges i vid udstrækning i bakteriologilaboratorier på grund af dets høje effektivitet til genopretning af Shigella og har også en god genopretning af Salmonella-slægten..
Rall et al. (2005) demonstrerede i deres arbejde med titlen "Evaluering af tre berigelsesbuljonger og fem faste medier til påvisning af Salmonella i fjerkræ", at af de 3 klassiske testede medier (lysegrøn agar, SS-agar og XLD-agar), XLD agar havde den bedste opsving.
Gendannelsesprocenterne var som følger: 13,8% for lysegrøn agar, 27,6% for SS og 34,5% for XLD. Det blev kun overgået af det kromogene medium Rambach-agar med 48% opsving og CHROMagar med 79,3%.
Referencer
- Fødevarebårne sygdomme. Shigellose. Tilgængelig på: anmat.gov.ar
- "XLD agar." Wikipedia, The Free Encyclopedia. 9. feb 2019, 11:46 UTC. 10. apr 2019, 19:25 wikipedia.org
- BBL-laboratorier. CHROMagar Salmonella / BD XLD Agar (biplat). 2013 Tilgængelig på: bd.com
- Lab. Neogen. XLD agar. Fås på: foodsafety.neogen
- Francisco Soria Melguizo Laboratory. XLD-agar. Tilgængelig på: http://f-soria.es/Inform
- Rall L, Rall R, Aragon C, Silva M. Evaluering af tre berigelsesbuljonger og fem udpladningsmedier til Salmonella-påvisning i fjerkræ. Braz. J. Microbiol. 2005; 36 (2): 147-150. Tilgængelig fra: scielo.br
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott mikrobiologisk diagnose. 12. udgave Redaktionel Panamericana S.A. Argentina.


Endnu ingen kommentarer